>> Tìm hiểu thêm về chùm bài nghiên cứu việc sử dụng tỏi để hỗ trợ điều trị COVID-19: tỏi & COVID-19 Archives – Book Hunter
- Tóm lược
Một phương pháp cải tiến để định lượng hợp chất dinh dưỡng allicin trong tỏi được trình bày nhằm tối ưu hóa tất cả các yếu tố chiết xuất, bao gồm thời gian ủ, chuẩn bị mẫu, chất chiết xuất và độ ổn định của allicin trong dịch chiết ở các điều kiện bảo quản khác nhau. Nồng độ allicin tối đa đạt được chỉ sau 5 phút ủ mẫu. Nồng độ allicin cao nhất được chiết xuất từ tép tỏi tươi (12 mg g-1 DW) và giảm khi dùng phương pháp đông khô (giảm ~15 %) hoặc sấy khô ở 55◦C (giảm ~40 %) hoặc 70◦C ( giảm ~70%). Trong số bảy chất chiết xuất được đánh giá, nước Milli-Q cho khả năng thu hồi allicin cao nhất so với 20% và 50% metanol (lần lượt là 93% và 88% thu hồi) và dung dịch đệm phốt phát pH 2.5 (thu hồi 93%). Allicin ổn định nhất (~98%) trong chiết xuất với sự có mặt của MeOH (60%) ở -20◦C trong tối đa 50 ngày. Giới hạn phát hiện thấp (0.09 μg mL-1), giới hạn định lượng (0.3 μg mL-1) và độ chính xác cao (92–95%) đã xác thực phương pháp được tối ưu hóa. Một đánh giá về phương pháp trên tám giống tỏi cho thấy sự khác biệt di truyền cao về nồng độ allicin (11.4–24.1 mg g-1 DW). Phương pháp được trình bày chính xác, tiện lợi và tiết kiệm thời gian hơn so với các phương pháp đã được báo cáo trước đó, nhưng quan trọng là xác định được quy trình sạch (dựa trên nước) để chiết xuất allicin dược phẩm.
II.Tổng quan về allicin có trong tỏi
Trên toàn thế giới, tỏi (Allium sativum L.) là một thành phần thực phẩm và gia vị quan trọng ở các nền văn hóa khác nhau (Martins và cộng sự, 2016). Tỏi có một nguồn phong phú các hợp chất lưu huỳnh hữu cơ, đặc biệt là alliin, chính hợp chất cay nồng allicin được tạo ra từ alliin thông qua quá trình phân cắt bằng enzym (Arthur và Ewald, 2006). Mặc dù allicin chịu trách nhiệm về hương vị cay nồng đặc trưng của nó, nhưng nó cũng có khả năng mang lại lợi ích cho sức khỏe con người (Randle và Lancaster, 2002), bao gồm hoạt tính kháng khuẩn (Fujisawa và cộng sự, 2009), hoạt tính chống ung thư (Suong và cộng sự, 2007), giảm cholesterol và cải thiện sức khỏe tim mạch (Rahman và Lowe, 2006; Vazquez-Prieto và Miatello, 2010). Do các đặc tính ẩm thực và dược liệu liên quan đến allicin, việc chiết xuất và định lượng allicin từ tỏi đã trở thành một chủ đề nghiên cứu.
Trong các tép tỏi nguyên vẹn, có sự phân tách không gian của enzyme alliinase chứa trong các tế bào vỏ bọc của bó (Ellmore và Feldberg, 1994) và alliin chứa trong các tế bào trung mô (Randle và Lancaster, 2002), do đó phản ứng tạo ra allicin không xảy ra. Khi mô tép tỏi bị phá vỡ (ví dụ: nghiền nát), alliin có thể nhanh chóng (<4 phút) được chuyển đổi thành allicin nhờ enzyme alliinase (Arthur và Ewald, 2006). Ban đầu, alliin bị alliinase phân cắt thành axit allysulfenic, dehydroalanine và NH3 (Hình S1). Sau đó, hai phân tử axit allysulfenic được liên hợp một cách tự nhiên với sự mất đi của một phân tử nước, tạo ra một phân tử allicin (Ilic và cộng sự., 2011; Mishra và cộng sự., 2001) đưa ra phép cân bằng hóa học lý thuyết về chuyển đổi alliin thành allicin là 2:1. Tuy nhiên, không phải tất cả alliin đều phản ứng với alliinase để tạo thành allicin và độ ổn định của allicin trong dung dịch chiết xuất có thể khác nhau (Freeman và Kodera, 1995; Wang và cộng sự, 2015), tùy thuộc vào điều kiện chiết xuất và bảo quản.
Hầu hết các phương pháp hiện tại để phân tích allicin đều có ba nhược điểm làm hạn chế tính hữu dụng của chúng trong nghiên cứu về động lực học của alliin và allicin. Thứ nhất, chất đệm chiết xuất có tính axit ức chế hoạt động của alliinase (Arthur và Ewald, 2006) (cao nhất ở khoảng pH 7 (Chhabria và Desai, 2018). Do đó, các chất chiết thường được sử dụng, dung dịch HCl (pH 2) (Zhu và cộng sự, 2016) hoặc dung dịch đệm phosphate (pH 2.5) (Mochizuki và cộng sự, 1997) có thể làm giảm khả năng thu hồi allicin. Thứ hai, việc sử dụng chất chiết xuất từ cồn có thể ức chế hoạt động của alliinase (Arthur và Ewald, 2006), mặc dù Fujisawa và cộng sự (2008) đã báo cáo rằng việc sử dụng ethanol dạng nước (20–100%, v/v) mang lại khả năng thu hồi allicin cao (~1.62 đến 1.95 mg g-1). Thứ ba, vì allicin là một hợp chất dễ bay hơi và không ổn định (Dethier và cộng sự, 2013; Lawson, 1998), nó dễ dàng bị bốc hơi vào khí quyển ở nhiệt độ cao (tức > 40◦C) (Miron và cộng sự, 2004), trong đó gần 90% allicin có thể bị mất trong vòng 3 giờ sau khi chiết xuất (Wang và cộng sự, 2015). Tuy nhiên, nhiệt độ 40◦C và thời gian chiết xuất dài (30-290 phút) đã được sử dụng trong quá trình chiết xuất allicin (Bose và cộng sự., 2014; Gandara-Ledezma và cộng sự., 2015; Mochizuki và cộng sự., 1997; Zhu và cộng sự., 2016). Do đó, cần phải đánh giá triệt để về ảnh hưởng của dung môi, nhiệt độ và thời gian chiết xuất allicin để tối đa hóa khả năng thu hồi allicin từ các mẫu tỏi.
Cả sấy khô trong lò (Lawson và Wang, 2001) và đông khô (Duan và cộng sự, 2015; Gonzalez và cộng sự, 2009) đều được khuyến nghị để lưu trữ các mẫu tỏi để phân tích allicin tiếp theo. Tuy nhiên, ảnh hưởng của các bước khác nhau trong quá trình chuẩn bị và làm khô mẫu đối với việc thu hồi allicin và hoạt động của alliinase vẫn chưa được thiết lập một cách thuyết phục. Đầu tiên, việc cắt nhỏ các tép tỏi ở nhiệt độ phòng (RT) để chuẩn bị cho việc sấy khô trong lò (Arnault và cộng sự, 2003; Baghalian và cộng sự, 2005; de Diego và cộng sự, 2007) giải phóng enzyme alliinase tại vết cắt (bị hư hỏng) bề mặt mà từ đó alliin được chuyển đổi thành allicin. Thứ hai, tỏi nghiền được sấy khô trong lò ở nhiệt độ cao (55◦C) có thể dẫn đến sự thất thoát và phân hủy allicin dễ bay hơi trong quá trình sấy khô. Cuối cùng, sấy khô ở nhiệt độ cao (ví dụ: 70◦C) và đông khô có thể làm giảm hoạt động của alliinase (Krest và Keusgen, 1999; Lawson và Wang, 2001), sau đó sẽ làm giảm quá trình chuyển đổi alliin thành allicin. Do đó, việc nghiên cứu thêm về các kỹ thuật chuẩn bị mẫu là cần thiết để tối ưu hóa phương pháp.
Nghiên cứu này nhằm tối đa hóa khả năng thu hồi allicin từ các mẫu tỏi bằng cách tối ưu hóa phương pháp chuẩn bị mẫu và xác định chất chiết xuất lý tưởng. Việc xác nhận phương pháp được tối ưu hóa để xác định allicin trong tỏi là rất quan trọng để định lượng chính xác nồng độ allicin trong các mẫu tỏi.
III. Vật liệu và phương pháp nghiên cứu
- Nguyên liệu thực vật và thuốc thử
Tỏi (cv. Glenlarge) được trồng trong điều kiện cận nhiệt đới tại Bộ Nông nghiệp và Thủy sản của Chính phủ Queensland, Cơ sở Nghiên cứu Gatton, Queensland, Úc (nằm ở 27.55◦Nam, 152.33◦Đông và 93m trên mực nước biển). Những tép tỏi lớn chất lượng cao được trồng vào tháng 3 năm 2018 được trồng trong vụ đông và thu hoạch vào tháng 10 năm 2018 khi khoảng 70% tán lá đã già. Củ sau khi thu hoạch được xử lý trong nhà kho có mái che, thông gió tốt trong 4 tuần ở điều kiện môi trường. Sau khi xử lý, 5 củ đã được lựa chọn và 2 tép được loại bỏ khỏi mỗi củ để nghiên cứu về việc tối ưu hóa và xác nhận phương pháp phân tích và chiết xuất allicin.
Tám giống tỏi bao gồm hai giống của Úc (Glenlarge và Southern Glen) và sáu giống có nguồn gốc từ bộ sưu tập của Trung tâm Rau Thế giới có nguồn gốc từ Indonesia (VFTA336M3), Philippines (VFTA547(2-1), Trung Quốc (VFG178HP2), Đài Loan (VFG29M1), Brazil (VFG141M2) và Jamaica (VFTA158M5) đã được thu thập để phân tích allicin.
Chất chuẩn allicin (SANTSC-202449A) (dung dịch gốc (5000 mg L-1)) được mua từ Công nghệ sinh học Santa Cruz (Dallas, Texas, Mỹ). Tất cả các hóa chất và dung môi là loại HPLC hoặc loại phân tích.
Nước Milli-Q water – hay nước siêu tinh khiết (MQ) (Millipore Australia Pty Ltd, Kilsyth, Victoria, Australia) đã được sử dụng trong suốt nghiên cứu.
- Điều kiện phân tích
Phương pháp sắc ký lỏng khối phổ hiệu năng cực cao được sử dụng để xác định allicin. Hệ thống này bao gồm máy quang phổ khối Shimadzu UHPLC-PDA-ESI-MS/MS (Shimadzu, Kyoto, Nhật Bản) kết hợp với máy quang phổ khối ba tứ cực MS-8060 (Shimadzu, Kyoto, Nhật Bản). Nguồn phun ion hóa Electrospray (ESI) được vận hành với dòng khí máy phun sương ở 2 L phút-1, dòng khí sấy khô ở 10 L phút-1, nhiệt độ đường khử (DL) là 250◦C và nhiệt độ khối nhiệt là 400◦C. Allicin được phân tách trên cột Acquity UPLC BEH C18 pha đảo ngược (đường kính trong 150 × 2.1 mm, kích thước hạt 1.7 um; Waters, Dublin, Ireland). Pha động cho quá trình rửa giải bắt đầu theo phương pháp đẳng quyền bằng cách sử dụng 20% aceto-nitrile và 80% nước tinh khiết MQ trong 1 phút, sau đó là tăng tuyến tính từ 20% lên 60% acetonitril trong 13 phút, phương pháp ở mức 60% acetonitril trong 0.5 phút điều hòa lại trong 0.5 phút và cân bằng lại trong 2 phút nữa. Thời gian rửa giải cho allicin là 12.5 phút với tốc độ dòng chảy là 0.2 mL phút-1. Giám sát ion tiền chất ở năng lượng va chạm -20 V và MS quét toàn bộ ở chế độ dương nằm trong khoảng m/z 70-500. Phần mềm LabSolutions LC–MS Ver.5.85 (Shimadzu) được sử dụng để điều khiển thiết bị và xử lý dữ liệu.
Sắc ký lỏng hiệu năng cao với PDA được sử dụng để định lượng allicin thông thường. Hệ thống bao gồm một Shimadzu HPLC-PDA (Shimadzu, Kyoto, Nhật Bản) với cột Agilent Varian C18 (250mm x 4,6mm, 5μm) ở nhiệt độ phòng. Pha động là 20% acetonitril trong 1 phút, sau đó tăng tuyến tính từ 20% lên 60% acetonitril trong 17 phút. Sau đó, cột được làm sạch bằng acetonitril 60% trong 1 phút, được điều hòa lại trong 1 phút và được cân bằng lại trong 4 phút nữa. Phổ UV được chụp từ máy dò PDA trong khoảng 190–400 nm và allicin được phát hiện ở 245 nm. Thời gian rửa giải cho allicin là 19 phút với tốc độ dòng chảy là 0,6 mL phút-1. Phần mềm LabSolutions Ver.5.97 (Shimadzu) đã được sử dụng để điều khiển thiết bị và xử lý dữ liệu.
- Tối ưu hóa dung dịch chiết và quy trình chiết
Bảy phương pháp xử lý chiết xuất (Bảng 1) được đánh giá dựa trên các phương pháp trước đó của Fujisawa và cộng sự., (2008); Fujisawa và cộng sự., (1991) và Fujisawa và cộng sự., (1997). Mỗi pha xử lý được lặp lại ba lần. Các mẫu tép tỏi tươi đã chọn được bóc vỏ và nghiền nát bằng dụng cụ ép tỏi cầm tay có bán trên thị trường và giữ trong 5 phút ở 4◦C trong cốc có mỏ. Một mẫu phụ (khoảng 1g) của mẫu đã nghiền được cân chính xác và chuyển vào ống ly tâm 50 mL, trước khi thêm một trong bảy dung dịch đồng hóa (10 mL) tương ứng vào mỗi ống (dung dịch 1, Bảng 1). Sau đó, các ống chứa bùn đặc được đặt trong bể nước đá (0-4◦C) và các mẫu được đồng nhất trong 1 phút bằng thiết bị đồng nhất Heidolph Silentcrush M (Schwabach, Đức). Sau đó, 30 mL dung dịch chiết (dung dịch 2, Bảng 1) được thêm vào các ống, sau đó lắc trong 10 phút ở nhiệt độ phòng (RT), rồi ly tâm ở 5820×g trong 10 phút ở 4◦C. Phần nổi phía trên được thu thập và phần còn lại được chiết xuất lại với 10 mL dung dịch chiết tiếp theo (dung dịch 2) (Bảng 1). Hai chất nổi trên bề mặt được kết hợp cho mỗi lần xử lý và được lọc qua bộ lọc ống tiêm PTFE ưa nước 0.22 μm vào các lọ HPLC và được phân tích ngay lập tức, tuy nhiên, dịch chiết có thể được bảo quản tới 24 giờ ở 4◦C.
- Thời điểm tối ưu để giải phóng allicin
Một thí nghiệm đã được tiến hành để đánh giá sự thay đổi nồng độ allicin theo thời gian từ khi ngâm mô tỏi ban đầu, nghĩa là, điểm bắt đầu chuyển đổi alliin thành allicin, cho đến khi kết thúc phản ứng chuyển đổi. Các mẫu tép tỏi tươi được bóc vỏ, nghiền nát và đồng nhất trong 1 phút trong bể nước đá (0-4◦C). Các mẫu phụ khoảng 2g bột nhão được cân chính xác vào từng cốc trong số ba cốc 250 mL (lặp lại), sau đó vào mỗi cốc, 200 mL nước MQ được thêm vào ở RT. Một phần 2.0 mL bùn đặc được lấy ở 0.5, 2, 5, 10, 15, 20, 25, 30 và 40 phút và cho vào ống nhựa 20 mL chứa 8.0 mL HCl 0.1 M để chấm dứt quá trình chuyển hóa tiếp theo của alliin thành allicin. Sau đó, mẫu được ly tâm ở 5820× g trong 2 phút ở 4◦C và phần nổi phía trên được lọc qua bộ lọc ống tiêm PTFE ưa nước 0.22 μm vào lọ HPLC để phân tích allicin.
5.Ảnh hưởng của phương pháp xử lý mẫu làm khô đến nồng độ allicin
Ba phương pháp sấy khô, mỗi phương pháp lặp lại ba lần, được áp dụng cùng với tép tỏi tươi và hàm lượng allicin trong nguyên liệu sấy khô được so sánh với các mẫu tươi (phương pháp 1).
Trong phương pháp 1, một mẫu mới nghiền khoảng 1g được cân chính xác và chuyển vào ống ly tâm 50 mL, đặt trên đá (0-4◦C), 10 mL nước MQ được thêm vào ở RT và mẫu sau đó được đồng nhất hóa trong 1 phút. Sau đó, thêm 30 mL nước MQ ở RT nữa vào ống, dung dịch được lắc trong 10 phút ở RT, sau đó ly tâm ở 5820×g trong 10 phút ở 4◦C. Phần còn lại của mẫu tươi được cân chính xác và sấy khô ở 70◦C trong 3 ngày và trọng lượng khô được xác định từ đó tính nồng độ chất khô.
Ở phương pháp 2 và 3, tép tỏi được sấy khô ở hai nhiệt độ cao. Tỏi được bóc vỏ và thái thành từng miếng 3 cm. Các mảnh này ngay lập tức được sấy khô trong lò ở nhiệt độ 55◦C (phương pháp 2) (Lawson và Wang, 2001) hoặc 70◦C (phương pháp 3) trong 3 ngày. Sau khi sấy khô, tỏi khô được nghiền bằng máy xay gia dụng (Magic Bullet™) và mẫu khô (0.5 g) được chiết xuất như đã phác thảo cho phương pháp1.
Ở phương pháp 4, tép tỏi được làm đông khô. Tỏi tươi bóc vỏ được ngâm trong nitơ lỏng và đông khô trong 5 ngày, nghiền và chiết xuất 0.5 g mẫu khô như đã phác thảo cho phương pháp1.
6.Tính ổn định của allicin trong chiết xuất
Một thí nghiệm giai thừa đã được tiến hành để đánh giá tính ổn định của allicin trong các mẫu chiết xuất tỏi được bảo quản trong hai dung môi ở các nhiệt độ và thời lượng khác nhau. Allicin được chiết xuất từ một mẫu tỏi tươi bằng nước MQ theo 2.4. Chiết xuất allicin được chia thành hai đợt. Mẻ 1 được pha loãng với dung dịch nước MeOH 60% chứa 0.1% axit formic (Aala và cộng sự., 2012) và mẻ 2 được pha bằng nước MQ (đối chứng). Mỗi lô được chia thành ba phần và được bảo quản ở các nhiệt độ khác nhau, tức RT (khoảng 23◦C), 4◦C và -20◦C. Nồng độ allicin trong các mẫu được đo bằng HPLC (như mô tả ở trên) sau thời gian bảo quản 0, 2, 7, 14, 21, 35 và 50 ngày. Độ ổn định của allicin được tính toán như sau:

7.Xác nhận các phương pháp định lượng allicin
Việc xác định giới hạn phát hiện (LOD) và giới hạn định lượng (LOQ), hiệu ứng nền cũng như độ chính xác và độ chính xác dựa trên hướng dẫn của NATA (Hiệp hội các cơ quan kiểm tra quốc gia, Úc) (NATA, 2018). LOD và LOQ của allicin được xác định theo tỷ lệ tín hiệu trên nhiễu lần lượt là 3:1 và 10:1 từ một loạt tám nồng độ allicin (0.01, 0.03, 0.07, 0.1, 0.3, 0.7, 1.0 và 3.0 mg L-1).
Để đánh giá hiệu ứng nền, các tép tỏi còn nguyên vẹn được đun sôi trong nước trong 10 phút để làm biến tính enzyme alliinase nhằm ngăn chặn quá trình chuyển đổi alliin thành allicin. Mẫu đã đun sôi được nghiền và chiết bằng nước MQ để thu được dung dịch nền tỏi. Một dung dịch không có nền cũng được chuẩn bị bao gồm 60% MeOH và 40% MQ nước chứa 0.1% axit formic. Hai đường cong hiệu chuẩn tuyến tính được thiết lập từ một loạt tám nồng độ allicin (5, 10, 30, 50, 70,100, 200 và 400 mg/L) (7 lần lặp lại) bằng cách pha loãng tiêu chuẩn allicin (dung dịch gốc 5000 mg/L-1) với dung dịch nền tỏi và dung dịch không nền.
Hiệu ứng nền được tính toán bằng cách so sánh sự khác biệt giữa độ dốc của các phương trình đối với đường cong hiệu chuẩn của nền tỏi và dung dịch không có nền (Sm/Ss). Tỷ lệ của hai độ dốc cho thấy ảnh hưởng của các hợp chất đi kèm đối với tín hiệu allicin (NATA, 2018).

Để đánh giá độ chụm và độ chính xác của phương pháp được tối ưu hóa, các giá trị độ chụm trong ngày và giữa các ngày của phương pháp được đánh giá như mô tả trước đây của Hong và cộng sự (2020). Tóm lại, ba nồng độ allicin khác nhau (thấp ở mức 50, trung bình ở mức 100 và cao ở mức 200 μg mL-1) được thêm vào mẫu không có chất nền (ba lần lặp lại cho mỗi nồng độ) trước khi chiết xuất bằng nước MQ trong vòng một ngày và sau đó lặp lại trong ba ngày liên tiếp. Chiết xuất allicin đã được phân tích trên HPLC-PDA. Quá trình trích xuất tương tự được thực hiện trong hai tuần sau đó bởi một nhà điều hành khác và được phân tích trên UHPLC-PDA. Độ chính xác được xác định bởi độ lệch chuẩn tương đối (RSD) theo sau là phương trình:
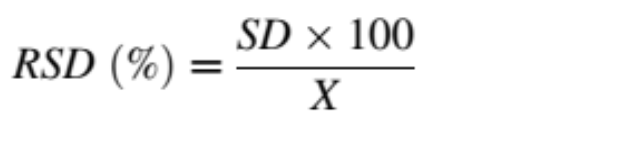
Trong đó SD là độ lệch chuẩn của 3 lần lặp lại và X là giá trị trung bình của 3 lần lặp lại
Độ chính xác của phương pháp chiết xuất allicin được xác định bằng phương trình:
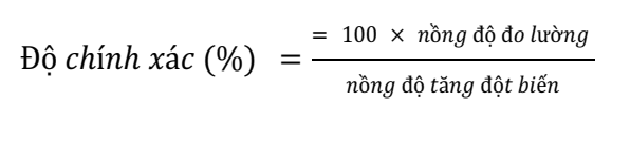
8.Phân tích thống kê
Dữ liệu được phân tích bằng phần mềm Minitab 18.1 cho Windows (Minitab Inc, State College, Pennsylvania, Mỹ), sử dụng ANOVA một chiều và hai chiều. Sự khác biệt đáng kể giữa các phương tiện xử lý được xác định bằng Tukey’s HSD với p <0.05. Các biểu đồ được trình bày dưới dạng lỗi trung bình và tiêu chuẩn bằng phần mềm SigmaPlot 14.0 (Systat Software Inc, Mỹ)
IV.Kết quả và thảo luận
1.Xác định allicin trong tỏi
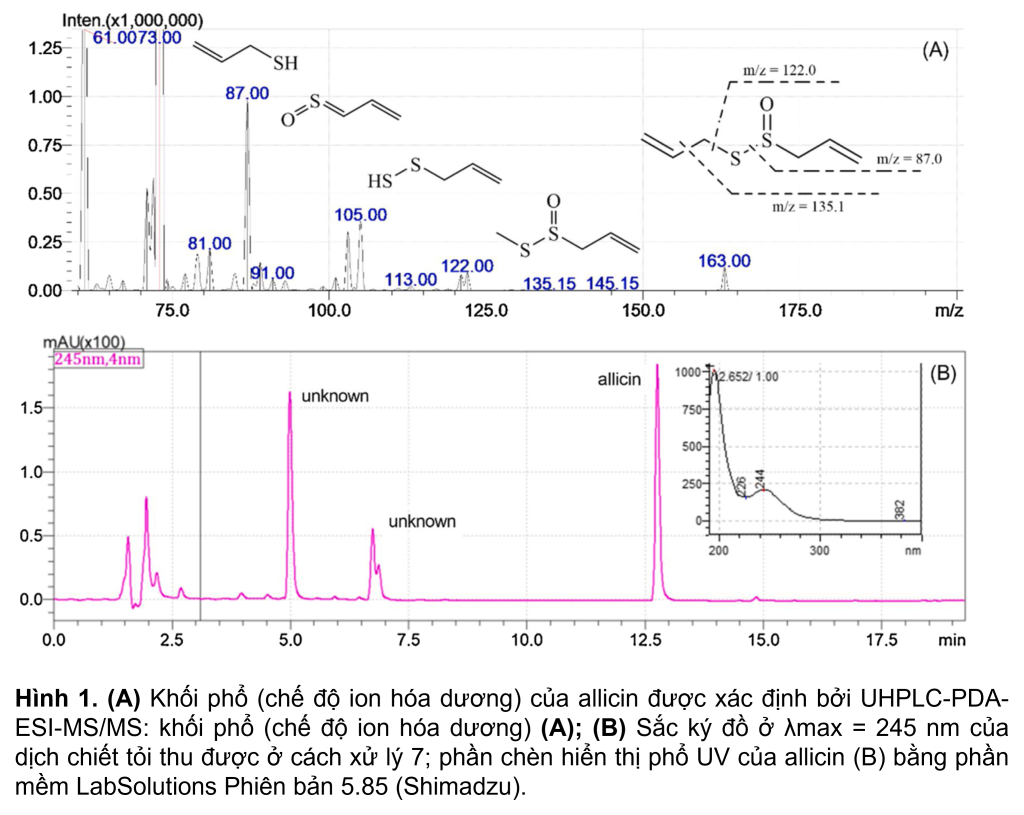
Chất chuẩn tham chiếu allicin được phân tích cùng với các mẫu tỏi và cho thời gian lưu là 12.8 phút, và mức hấp thụ tia cực tím tối đa trong dung môi rửa giải ở bước sóng 244 nm (Hình 1B) bằng hệ thống UHPLC. Phép đo khối phổ cũng được sử dụng để xác định khối lượng phân tử và các kiểu phân mảnh cụ thể của allicin (Hình 1A). Dựa trên mẫu phân mảnh MS/MS tương ứng của nó, allicin (Hình 1A) được xác định bởi ion phân tử ở m/z 163 [M+H]+ và sự hình thành ion mảnh ở m/z 135 [M+H– 28]+, tương ứng với sự mất mát của C2H4. Ion mảnh m/z 105 [M+H-58]+ được hình thành từ ion tiền chất bị phân cắt, C3H6O. Các ion mảnh ở m/z 87 [M+H-76]+ và m/z 73[M+H-90]+ là các mảnh allicin chiếm ưu thế sau khi mất nhóm C3H8S và C3H6SO (Hình 1b). Phân tích định kỳ allicin trong các mẫu tỏi bằng HPLC-PDA dựa trên thời gian lưu và phổ hấp thụ của đỉnh allicin giả định.
2.Tối ưu hóa giải pháp chiết xuất allicin
Là một chất đồng nhất, nước MQ cho khả năng thu hồi allicin lớn nhất chiết xuất khoảng 12.5 mg g-1 trọng lượng khô (DW) allicin (T5, T6 và T7) (Hình 2) cho thấy nước là chất nền tốt nhất để tạo thuận lợi cho quá trình chuyển đổi alliin thành allicin. Ngược lại, sử dụng dung dịch đệm phosphate (T3 và T4) hoặc MeOH (50% hoặc 20% v/v) (T1 và T2) trong quá trình đồng nhất mẫu giúp thu hồi allicin (p < 0,05) thấp hơn đáng kể (Hình 2). Hoạt động của enzyme alliinase bị ức chế bởi độ pH thấp của dung dịch chiết xuất đã axit hóa (pH 2.5) (T3 và T4). Khoảng 11.8 mg g-1 allicin (DW) thu được bằng cách sử dụng dung dịch đệm phosphate ở pH 2.5 làm chất chiết, có (T3) hoặc không có dung dịch nước MeOH (50%) (T4). Phát hiện này được hỗ trợ bởi một nghiên cứu của Arthur và Ewald (2006) về hoạt động tối ưu của alliinase trên pH, cho thấy 80% alliin phản ứng với alliinase trong khoảng pH từ 5.0–8.0, trong khi hoạt động của alliinase giảm xuống chỉ còn 20%. ở pH 4.0 và trên 8.0. Việc sử dụng MeOH làm dung dịch chiết ở nồng độ 50% (T1) hoặc 20% (T2) cho nồng độ allicin thấp hơn (tương ứng ~ 11.0 và 11.6 mg g-1 DW) (Hình 2). Những phát hiện này được hỗ trợ bởi Arthur và Ewald (2006), nhóm nghiên cứu này đã phát hiện ra rằng việc thu hồi allicin giảm khi tăng nồng độ MeOH do ức chế hoạt động của alliinase và giảm độ hòa tan của alliin. Tuy nhiên, trái ngược với cả hai phát hiện này, Fujisawa và cộng sự (2008) cho thấy chất chiết xuất MeOH (ở nồng độ 20 –100%) cho khả năng thu hồi allicin cao hơn so với nước.
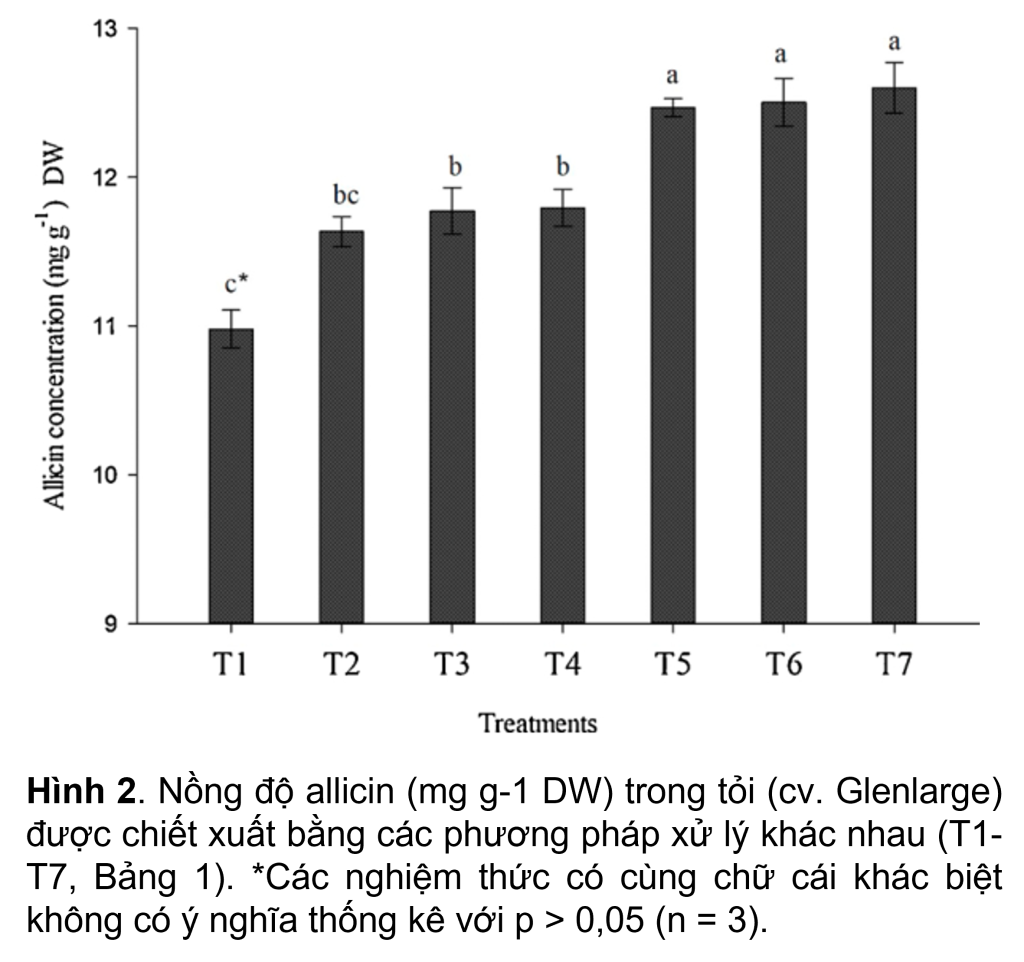
3.Thời gian giải phóng allicin trong tỏi
Phản ứng chuyển alliin thành allicin diễn ra nhanh chóng ngay sau khi đồng nhất mẫu. Ở lần lấy mẫu đầu tiên (0.5 phút), nồng độ allicin là khoảng 8.3 mg g-1 DW (Hình 3). Điều này chỉ ra rằng sự hình thành đáng kể của allicin (>~65%) đã xảy ra trong giai đoạn đồng nhất hóa 1 phút và ngâm trong 0.5 phút do allicin không có trong các tép tỏi nguyên vẹn (Ellmore và Feldberg, 1994; Randle và Lancaster, 2002).
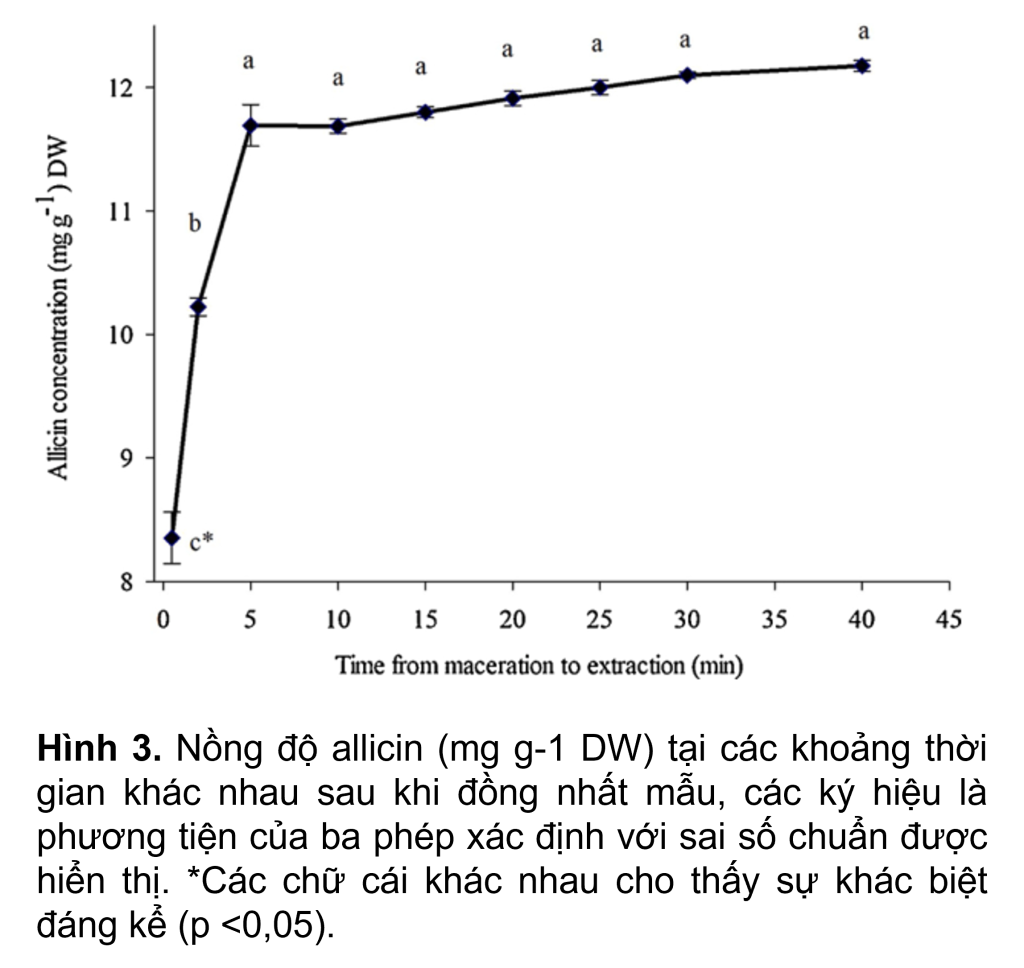
Nồng độ allicin tăng đáng kể lên khoảng 11.7 mg g-1 DW sau 5 phút, tại thời điểm đó về cơ bản tất cả alliin đã được chuyển đổi thành allicin. Với sự gia tăng tiếp theo về thời gian lấy mẫu từ 5 đến 40 phút sau khi chiết xuất, nồng độ allicin tăng dần lên mức tối đa là 12.2 mg g-1 DW, nhưng trong khung thời gian này, không có sự khác biệt đáng kể về nồng độ allicin (p < 0.05) . Để củng cố điều này, Arthur và Ewald (2006) đã phát hiện ra rằng alliin nguyên chất phản ứng hoàn toàn với alliinase chỉ trong 4 phút.
Do đó, quá trình chiết xuất allicin có thể được tiến hành trong khoảng thời gian từ 5 phút đến 40 phút mà không có bất kỳ thay đổi đáng kể nào về nồng độ allicin.
4.Ảnh hưởng của phương pháp sấy mẫu đến nồng độ allicin
Có sự khác biệt đáng kể (p <0.05) về nồng độ allicin trong ba phương pháp xử lý mẫu sấy khô so với các mẫu tươi (Hình 4). Nồng độ allicin cao nhất được đo trong các mẫu tươi (~12 mg g-1 DW), tiếp theo là các mẫu đông khô (~10 mg g-1) (tỷ lệ thu hồi 83%). Nồng độ allicin thấp hơn đáng kể trong các mẫu được sấy khô trong lò ở 55◦C (~7.1 mg g-1) (thu hồi 59%) và giảm hơn nữa trong các mẫu được sấy khô ở 70◦C (~4 mg g-1 DW) (thu hồi 33%).

Nồng độ allicin thấp được quan sát thấy trong các mẫu sấy khô trong lò (70◦C và 55◦C) có thể là do sự giải phóng allicin trên bề mặt cắt, sau đó bị mất đi trong quá trình sấy khô. Hơn nữa, nhiệt độ cao cũng có thể làm giảm hoạt động của enzyme alliinase, dẫn đến khả năng thu hồi allicin thấp hơn (Lawson và Wang, 2001). Việc đông khô tép tỏi làm biến tính enzyme alliinase (Lawson và Wang, 2001) có thể dẫn đến nồng độ allicin thấp hơn trong các mẫu. Xử lý các mẫu tươi dường như là lựa chọn tốt nhất để tối đa hóa việc thu hồi allicin từ các mẫu. Để bảo quản mẫu trong thời gian dài hơn, khi không thể sử dụng mẫu tươi, đông khô là một lựa chọn tốt hơn đáng kể (p < 0.05) so với sấy khô trong lò (Hình 4).
- Độ ổn định của Allicin
Độ ổn định của allicin trong chiết xuất được bảo quản trong dung dịch nước MeOH (60%) hoặc nước MQ đã được kiểm tra ở ba nhiệt độ (-20◦C, 4◦C và RT). Độ ổn định của allicin thay đổi đáng kể theo thời gian với các điều kiện bảo quản khác nhau (p <0.05) (Hình 5).
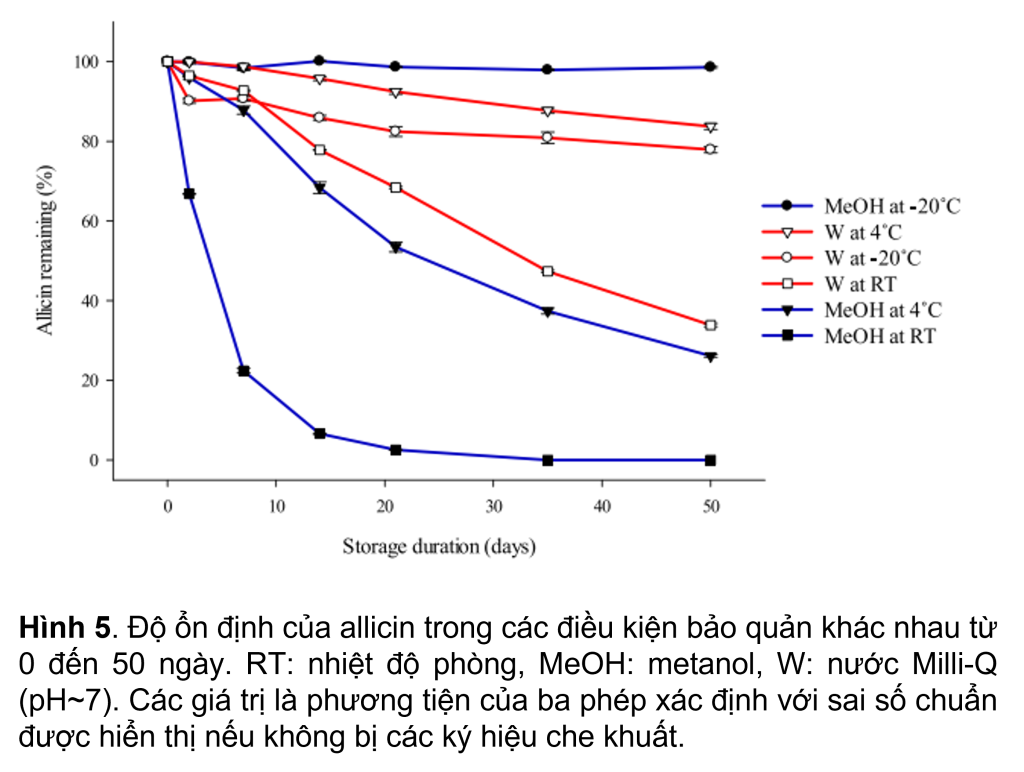
Trong MeOH, thu hồi allicin giảm đáng kể khi tăng nhiệt độ theo thời gian. Ở -20◦C allicin vẫn ổn định trong 50 ngày, với ~98.5% allicin được thu hồi từ chiết xuất, trong khi ở 4◦C ~68% allicin được đo sau 14 ngày và giảm xuống còn ~26% sau 50 ngày.
Tuy nhiên, tại RT, sự thu hồi allicin đã giảm đáng kể xuống còn 6% sau 6 ngày và dưới 1% sau 35 ngày. Ilic và cộng sự (2012) đã xác định sự biến đổi của allicin thành các sản phẩm thứ cấp khi có mặt metanol ở nhiệt độ cao lên tới 55◦C. Tuy nhiên, kết quả hiện tại trái ngược với kết quả của Fujisawa và cộng sự (2008) cho thấy 50% MeOH là dung môi tốt hơn trong việc duy trì allicin ở RT (~50% thu hồi) so với nước (~19%).
Riêng đối với nước MQ, sau 7 ngày bảo quản, nồng độ allicin giảm chậm, với hơn 90% allicin còn lại ở mỗi nhiệt độ, đặc biệt là ở 4◦C, nơi 98% allicin được thu hồi.
Sau 50 ngày bảo quản, thu hồi allicin ở 4◦C (83%) cao hơn ở -20◦C (78%) hoặc RT (34%). Phát hiện của Wang và cộng sự (2015) chỉ ra rằng allicin ổn định hơn ở -20◦C (~98% lượng allicin còn lại) so với ở 4◦C (~68% lượng allicin còn lại) sau 30 ngày bảo quản cho thấy rằng việc bảo quản ở nhiệt độ thậm chí còn thấp hơn đã được đánh giá trong nghiên cứu này có thể được đảm bảo nếu cần lưu trữ mẫu lâu dài. Nói chung, các chất chiết xuất có thể được bảo quản trong nước MQ ở 4◦C trong tối đa 7 ngày mà không làm giảm đáng kể (p < 0,05) allicin. Việc bổ sung dung dịch nước metanol (60%) và bảo quản ở -20◦C mang lại khả năng thu hồi lâu dài nhất và tốt hơn là tối đa hóa độ ổn định của allicin.
6.Tính hợp lệ của phương pháp phân tích allicin
LOD, LOQ và hiệu ứng nền
Các giá trị LOD, LOQ và hiệu ứng nền để xác định allicin được trình bày trong Bảng 2. Đường chuẩn cho các tiêu chuẩn allicin (5–400 mg L-1), là tuyến tính với hệ số tương quan cao (r2 = 1.0) trong khoảng nồng độ hoạt động. Hiệu ứng nền là khoảng 3.3% và chỉ ra rằng các tương tác nền là không đáng kể và không ảnh hưởng đến độ chính xác của phương pháp.
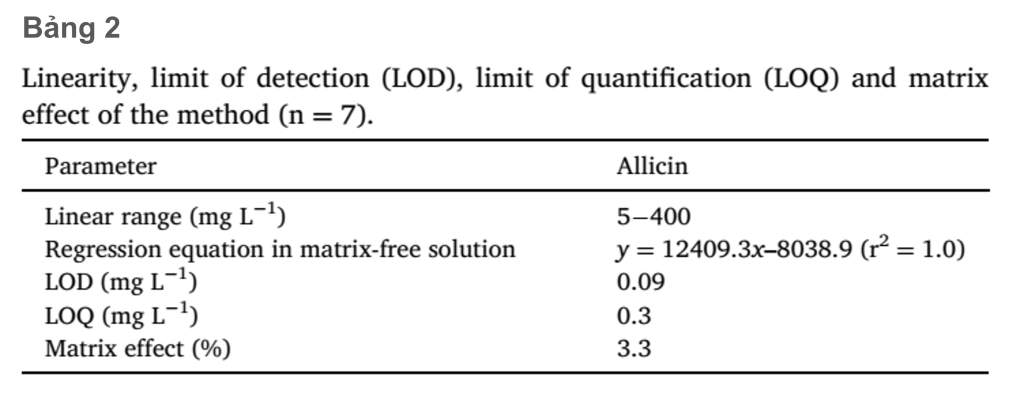
LOD (0.09 mg/L-1) và LOQ (0.3 mg/L-1) đã chứng minh rằng nồng độ allicin thấp có thể được định lượng chính xác bằng hệ thống HPLC-PDA.
Độ chính xác và độ chụm
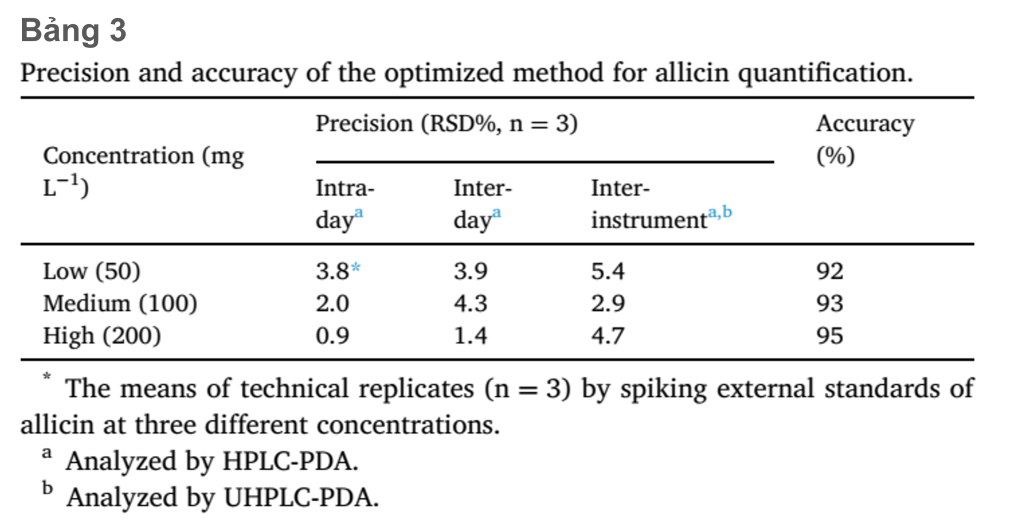
Độ lệch chuẩn tương đối (RSD%) dao động trong khoảng 0.9–3.8% (đối với biến thiên trong ngày) và 1.4–4.3% (đối với biến thiên giữa các ngày) trên ba nồng độ tiêu chuẩn allicin bên ngoài (thấp 50 mg L-1, trung bình 100mg L-1 và cao 200mg L-1). Mặc dù có RSD% cao hơn giữa các công cụ phân tích (2.9 và 5.4%), RSD% thấp cho giữa ngày và trong ngày cho thấy đây là mức độ chính xác có thể chấp nhận được đối với các phương pháp được đề xuất (Snyder và cộng sự, 1997) (bảng 3). Sự thu hồi của allicin dao động từ 92% đến 95% (Bảng 3), cho thấy độ chính xác thỏa đáng đối với phương pháp hiện tại (Ermer và cộng sự., 2014)
Định lượng allicin trong các giống tỏi
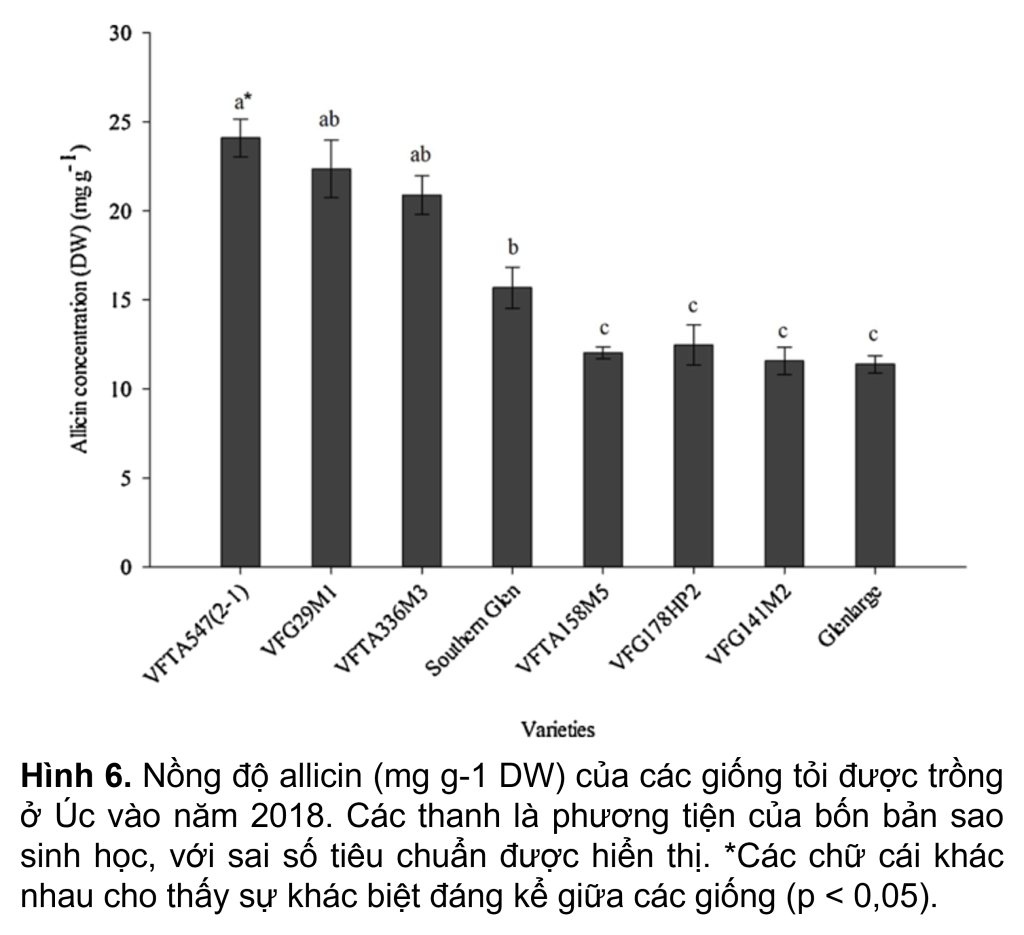
Phương pháp được tối ưu hóa và kiểm chứng đã được sử dụng để đánh giá nồng độ allicin của tám giống tỏi được trồng ở Úc vào tháng 3 năm 2018 với bốn lần lặp lại. Tất cả các giống tỏi được trồng ở Úc trong các điều kiện giống hệt nhau vào tháng 3 năm 2018. Nồng độ allicin thay đổi đáng kể giữa các giống, dao động từ 11.4–24.1 mg g-1 trên cơ sở trọng lượng khô (từ 3.9 đến 6.6 mg g-1 trên trọng lượng tươi ( FW) cơ sở). Trong số tám giống cây trồng, VFTA547(2-1) có nồng độ allicin cao nhất (6.3 mg g-1 FW hoặc 24.1 mg g-1 DW) và VFTA158M5, VFG178HP2, VFG141M2 và Glenlarge (~ 4.0 mg g-1 FW hoặc ~ 11.4 mg g-1 DW) có nồng độ allicin thấp nhất trên cơ sở FW và DW (Hình 6). Nồng độ allicin trên cơ sở FW của cv. Glenlarge thấp hơn một chút so với nghiên cứu của David và Sam (2000) (5.0 mg g-1) người đã tăng cv. Glenlarge ở Gatton vào năm 1997. Tuy nhiên, phạm vi nồng độ allicin của tám giống trong nghiên cứu hiện tại nằm trên phạm vi được báo cáo đối với 93 giống tỏi được trồng ở Ấn Độ, dao động từ 1.5 đến 5.3 mg g-1 FW hoặc 5.0–18.2 mg g-1 DW (Khar và cộng sự 2011).
V.Kết luận
Một quy trình toàn diện để chiết xuất allicin từ tép tỏi đã được phát triển nhằm tối ưu hóa quá trình chuẩn bị tép tỏi, dung dịch chiết allicin, thời gian ủ mẫu và xác định chất nền bảo quản tốt nhất để chiết xuất allicin ổn định lâu dài. Nồng độ allicin tối đa thu được sau thời gian ủ mẫu >5 phút tại RT.
Nước MQ là môi trường tốt nhất để đồng nhất hóa và chiết xuất allicin từ tỏi, cho năng suất allicin cao nhất, trong khi các chất chiết xuất bằng metanol hoặc axit kém hiệu quả hơn. Lượng allicin lớn nhất được chiết xuất từ tép tỏi tươi (~12 mg g-1 DW) và lớn hơn đáng kể so với tỏi đông khô (~10 mg g-1 DW) hoặc từ tỏi được sấy khô ở bất kỳ nhiệt độ nào. 55◦C (~7 mg g-1 DW) hoặc 70◦C (~4 mg g-1 DW). Chiết xuất allicin ổn định trong nước MQ ở 4◦C trong tối đa 7 ngày (khôi phục 98,3%), nhưng để bảo quản lâu dài (lên đến 50 ngày), bổ sung thêm MeOH (6%) và bảo quản ở – 20◦C được khuyến nghị để mang lại độ ổn định cao nhất (~98,5%). Phương pháp đã được xác thực có LOQ và LOD thấp, đồng thời có độ chính xác và độ chính xác cao, đồng thời là phương pháp tái sản xuất đáng tin cậy để định lượng allicin trong tỏi.
Do đó, các nghiên cứu được báo cáo trong bài báo này cung cấp một phương pháp chiết xuất đơn giản, chính xác và hiệu quả để định lượng allicin trong các mẫu tỏi tươi.
Người dịch: Sophia Ngo
Nguồn: Nguyen, Binh & Hong, Hung & O’Hare, T.J. & Wehr, J. Bernhard & Menzies, Neal & Harper, Stephen. (2021). A rapid and simplified methodology for the extraction and quantification of allicin in garlic. Journal of Food Composition and Analysis. 104. 104114. 10.1016/j.jfca.2021.104114.