>> Tìm hiểu thêm về chùm bài nghiên cứu việc sử dụng tỏi để hỗ trợ điều trị COVID-19: tỏi & COVID-19 Archives – Book Hunter
I. Tóm lược
Biểu mô đường thở đóng vai trò quan trọng trong việc điều chỉnh chất nhầy trên bề mặt đường thở (ASL), sự thay đổi của biểu mô này sẽ gây ra các triệu chứng ứ đọng chất nhầy. Allicin là một hợp chất được giải phóng từ tỏi và có khả năng bảo vệ phổi. Tuy nhiên, tác dụng điều chỉnh tiềm năng của allicin đối với biểu mô đường thở vẫn khó nắm bắt. Nghiên cứu này nhằm mục đích điều tra tác động của allicin đối với sự vận chuyển ion qua biểu mô đường thở và đánh giá tiềm năng của allicin như một chất long đờm. Ứng dụng về bài tiết Cl− do allicin tạo ra trên biểu mô đường thở theo cách phụ thuộc vào nồng độ. Ức chế chất điều hòa độ dẫn xuyên màng xơ nang (CFTR) hoặc ức chế con đường truyền tín hiệu adenylate cyclase-cAMP làm suy giảm bài tiết Cl− do allicin tạo ra ra trong các tế bào biểu mô đường thở. Nghiên cứu ở cơ thể sống (in vivo) cho thấy allicin dạng hít làm tăng đáng kể sự bài tiết ASL ở chuột. Những kết quả này cho thấy rằng allicin tạo ra sự bài tiết Cl− và chất lỏng qua biểu mô đường thở thông qua kích hoạt CFTR, có thể cung cấp các chiến lược điều trị để điều trị các bệnh phổi mãn tính liên quan đến mất nước ở ASL.
II. Tổng quan về bề mặt đường thở (ASL)
Là tuyến phòng thủ đầu tiên chống lại sự xâm nhập từ bên ngoài, biểu mô đường thở hoạt động như một rào cản đối với các hạt và mầm bệnh lắng đọng trong đường thở (Tam và cộng sự, 2011). Bề mặt bên trong của biểu mô đường thở được bao phủ bởi chất nhầy ở bề mặt đường thở (ASL), chủ yếu phát sinh từ các chất tiết của tuyến dưới niêm mạc và vận chuyển nước và điện giải qua biểu mô (Widdicombe, 2002) (Tam và cộng sự, 2011). ASL bao gồm một lớp chất nhầy và một lớp chất lỏng mỏng được gọi là lớp màng ngoài (PCL) bao quanh lông mao. Chất nhầy bẫy các hạt hít vào để loại bỏ bằng cách thanh thải chất nhầy, trong khi PCL giữ chất nhầy ở một khoảng cách vừa đủ với các tế bào biểu mô có lông mao để hoạt động tối ưu (Toosi, 2014) (Tarran và cộng sự, 2006). Tuy nhiên, khi sự cân bằng nội môi của ASL bị suy giảm, nó sẽ gây ra tình trạng mất nước trên bề mặt đường thở, chất nhầy quá đậm đặc, ảnh hưởng đến sự vận chuyển chất nhầy và chất nhầy dính vào bề mặt đường thở (Boucher, 2007b). Sự ứ đọng chất nhầy sau đó góp phần gây tắc nghẽn luồng không khí, nhiễm trùng dai dẳng và tiến triển, và các đặc điểm viêm của bệnh phổi tắc nghẽn mãn tính bao gồm xơ nang (CF), bệnh phổi tắc nghẽn mãn tính (COPD) và viêm phế quản mãn tính (Boucher, 2007a) (Boucher, 2004) ( Kesimer và cộng sự, 2018) (Evans và Koo, 2009). Quá trình hydrat hóa ASL và vận chuyển chất nhầy được điều hòa bởi các quá trình vận chuyển ion qua biểu mô, chủ yếu là bài tiết Cl− ở khoang và hấp thụ Na+ (Lazarowski và Boucher, 2021). Là kênh Ion âm (Anion) chính nằm ở đỉnh, chất điều chỉnh độ dẫn xuyên màng xơ nang (CFTR) đóng vai trò quan trọng trong việc điều hòa các chất điện giải và bài tiết dịch qua biểu mô đường thở (Boucher, 2019). Đột biến trong gen CFTR dẫn đến bài tiết Cl− bất thường cũng liên quan đến việc tăng cường hấp thụ Na+ (Gentzsch và cộng sự, 2010), dẫn đến suy giảm thể tích ASL (Tyrrell và cộng sự, 2015) (Cantin, 2016). Do đó, các loại thuốc có tác dụng điều hòa bài tiết Cl− qua trung gian CFTR có thể làm giảm các triệu chứng của các bệnh đường thở liên quan đến mất nước ASL ở một mức độ nào đó.
Allicin (tên IUPAC: 3-prop-2-enylsulfinylsulfanylprop-1-ene) là một diallyl thiosulfonate được tạo ra từ alliin trong tỏi (Allium sativum L.) thông qua tương tác với alliinase (Stoll và Seebeck, 1947). Là thành phần hoạt tính chính của tỏi, allicin chứa đựng đặc tính chống khối u, chống đái tháo đường, chống xơ vữa động mạch, bảo vệ phổi, bảo vệ gan và hoạt tính sinh học bảo vệ tim mạch (Rahman, 2007) (Dixit và Chaudhary, 2014) (Mandal và cộng sự, 2019). Các nghiên cứu trước đây cho thấy allicin có chức năng diệt khuẩn chống lại các tác nhân gây bệnh ở phổi như trực khuẩn mủ xanh, liên cầu khuẩn, và tụ cầu khuẩn (Reiter và cộng sự, 2017) (Cañizares và cộng sự, 2004). Tuy nhiên, tác dụng điều chỉnh của allicin đối với biểu mô đường thở vẫn chưa rõ ràng. Allicin có thể oxy hóa các nhóm sulfhydryl và dư lượng cysteine trên protein, do đó thay đổi trạng thái oxy hóa khử của tế bào và cấu trúc protein (Gruhlke và Slusarenko, 2012). Ngoài ra, allicin được báo cáo là làm tăng hàm lượng cAMP nội bào và điều hòa sự thư giãn của mạch máu thông qua con đường yếu tố siêu phân cực có nguồn gốc từ nội mô trong các tế bào nội mô mạch máu (Cui và cộng sự, 2020). Cho rằng CFTR được kích hoạt bằng cách tăng mức cAMP nội bào, có thể hợp lý là allicin có thể điều chỉnh cân bằng nội môi thể tích ASL bằng cách tạo điều kiện bài tiết Cl− thông qua kích hoạt CFTR. Do đó, nghiên cứu này nhằm mục đích điều tra các cơ chế làm cơ sở cho tác dụng điều tiết của allicin đối với sự vận chuyển ion qua biểu mô trong biểu mô đường thở và đánh giá tiềm năng của nó như một chất long đờm.
III. Phương pháp Nghiên cứu
Thuốc thử
Môi trường thiết yếu tối thiểu, huyết thanh bào thai bò, penicillin/streptomycin và trypsin được mua từ Gibco (Grand Island, NY, Hoa Kỳ). Allicin được cung cấp bởi Ailexin (Urumuqi, Trung Quốc). Amiloride, CFTRinh-172, DIDS, forskolin (FSK), isobutylmethylxanthine (IBMX) được mua từ Sigma-Aldrich (Missouri, Hoa Kỳ). SQ22536 được mua từ MedChemExpress (New Jersey, Hoa Kỳ). NaCl, KCl, MgSO4, NaHCO3, KH2PO4, CaCl2, glucose và gluconat được mua từ Nhà máy Dược phẩm Hóa chất Quảng Châu (Quảng Châu, Trung Quốc). HEPES được mua từ Mbchem Technology (Quảng Châu, Trung Quốc). Bộ xét nghiệm miễn dịch enzyme cAMP trực tiếp (KGE002B) đã được mua từ Hệ thống R&D (Minneapolis, MN, Hoa Kỳ). Bộ xét nghiệm protein axit bicinchoninic (kw0014) được mua từ KWBIO (Bắc Kinh, Trung Quốc).
Động vật
Chuột Côn Minh nặng 25-30g được mua từ Trung tâm Động vật Phòng thí nghiệm của Đại học Tôn Trung Sơn (Quảng Châu, Trung Quốc). Chuột được nhốt trong điều kiện cụ thể không có mầm bệnh với nhiệt độ phòng không đổi là 20°C và chu kỳ quang 12 L:12 D với thức ăn và nước uống tự do. Tất cả các thủ tục đã được phê duyệt bởi Ủy ban Chăm sóc và Sử dụng Động vật Thể chế (IACUC), Đại học Sun Yat-sen (Quảng Châu, Trung Quốc).
Nuôi cấy tế bào
Dòng tế bào biểu mô phế quản người 16HBE14o- và CF Dòng tế bào biểu mô phế quản người CFBE41o- được nhận như một món quà từ Giáo sư Wing-Hung Ko (Trường Khoa học Y sinh, Đại học Hồng Kông, Hồng Kông, Trung Quốc). Các tế bào được nuôi cấy trong môi trường thiết yếu tối thiểu được bổ sung 10% (v/v) huyết thanh bào thai bò và 1% (v/v) penicillin−streptomycin ở 37°C với 5% CO2 trong môi trường ẩm.
Các phép đo dòng điện ngắn mạch (ISC)
Phép đo ISC được thực hiện theo quy trình đã sửa đổi như đã mô tả trước đây (Zhang và cộng sự, 2018) (Cottrill và cộng sự, 2021). Tóm lại, các đơn lớp tế bào 16HBE14o- hoặc CFBE41o- phát triển trên màng lọc Millipore (Millipore) với đường kính lỗ 0,45 μm được kẹp theo chiều dọc giữa hai nửa của buồng sử dụng (Hệ thống buồng sử dụng EM-CSYS-2, Dụng cụ sinh lý, San Diego, Hoa Kỳ). Lớp tế bào đơn lớp hợp lưu được ngâm trong dung dịch Krebs-Henseleit (K-H) (115 mM NaCl, 5 mM KCl, 1 mM MgCl , 2 mM CaCl, 10 mM glucose, 25 mM NaHCO3) ở mặt bên và với nồng độ Cl- giảm (115 mM Na-gluconate, 5 mM KCl, 1 mM MgCl2, 4 mM CaCl2, 10 mM glucose, 25 mM NaHCO3) ở cạnh đỉnh để tạo ra gradient Cl− từ đáy đến đỉnh. Dung dịch được khí hóa với 95% O2/5% CO2 để thu được độ pH không đổi là 7,4 và duy trì ở 37°C trong suốt quá trình thí nghiệm. Biểu mô thể hiện sự chênh lệch điện thế cơ bản giữa biểu mô (PD), được đo bằng điện cực Ag/AgCl với cầu nối KCl/thạch kết nối với bộ khuếch đại kẹp điện áp (VCC MC6, Physiologic Instruments, San Diego, Mỹ). Đối với phép đo ISC, PD xuyên biểu mô của lớp đơn lớp hợp lưu được kẹp ở 0 mV. Sự thay đổi của ISC (Δ ISC), được định nghĩa là sự khác biệt giữa giá trị tại đường cơ sở và giá trị tại đỉnh sau khi kích thích, được hiển thị đồng bộ thông qua hệ thống thu thập và phân tích tín hiệu (hệ thống BL-420E+, Công ty TNHH Công nghệ & Thị trường Thành Đô., Thành Đô, Trung Quốc) và được chuẩn hóa theo đơn vị diện tích của chế phẩm (ΔμA/cm2). Khi bắt đầu và kết thúc mỗi thí nghiệm, xung 1 mV được áp dụng và sự thay đổi đáp ứng hiện tại được sử dụng để ước tính điện trở xuyên biểu mô theo định luật Ohm. Trong các thí nghiệm thay thế ion, HCO3− được thay thế bằng HEPES và Cl− được thay thế bằng gluconat. Dung dịch không chứa HCO3− được thông khí trong 100% O2.
Phân tích cAMP nội bào
Hàm lượng cAMP nội bào được đo bằng cách sử dụng bộ xét nghiệm miễn dịch enzyme cAMP trực tiếp (R&D Systems, KGE002B, Minneapolis, MN, Mỹ) theo hướng dẫn. Thử nghiệm dựa trên kỹ thuật liên kết cạnh tranh bằng cách sử dụng các kháng thể đơn dòng đặc hiệu cho cAMP. Tổng hàm lượng protein trong lysate được đo bằng bộ xét nghiệm protein axit bicinchoninic (KWBIO, kw0014, Bắc Kinh, Trung Quốc).
Đánh giá hoạt động tiền bài tiết của Allicin
Hoạt tính tiền bài tiết mạnh mẽ của allicin được đánh giá bằng xét nghiệm bài tiết đỏ phenol như đã mô tả trước đây (Menezes và cộng sự, 2019). Tóm lại, những con chuột được xử lý riêng bằng nước muối, allicin (100 μM, 200 μM và 400 μM ở liều thấp, liều trung bình và liều cao) hoặc salbutamol (1 mg/ml) bằng khí dung trong 30 phút kéo dài trong 4 những ngày liên tiếp. Những con chuột được tiêm trong màng bụng 5% (w/v) phenol đỏ hòa tan trong nước muối (50 μL/10g trọng lượng cơ thể) hoặc một lượng nhỏ nước muối làm đối chứng trong 30 phút sau lần phun sương cuối cùng. Sau đó, chuột đã được an tử bằng cách trật khớp cổ tử cung 30 phút sau khi tiêm phenol đỏ và các mẫu dịch phế quản phế nang (BALF) được thu thập. Các mẫu BALF được ly tâm ở tốc độ 650 × g trong 10 phút và được kiềm hóa bằng NaOH (0,1 mM). Sau đó, độ hấp thụ được đo ở bước sóng 565 nm trong máy đo quang phổ. Hiệu chuẩn của đỏ phenol được chuẩn bị với các nồng độ khác nhau của dung dịch đỏ phenol (0, 0.5, 1, 5, 10, 50, 100 ng/ml). Hiệu chuẩn có thể thu được bằng cách điều chỉnh nồng độ đỏ phenol tương ứng với độ hấp thụ với hàm tuyến tính “y = kx + b”. Nồng độ của đỏ phenol (ng/ml) trong các mẫu BALF sau đó đã được tính toán.
Phân tích và thống kê dữ liệu
Tất cả dữ liệu được trình bày dưới dạng trung bình ± độ lệch chuẩn (S.D.) với các dấu chấm riêng biệt cho mỗi phép đo. T-test của Student (hai đuôi) được sử dụng để so sánh sự khác biệt giữa hai nhóm. Đối với ba nhóm trở lên, dữ liệu được phân tích với phân tích phương sai một chiều, sau đó là nhiều thử nghiệm so sánh của Tukey (GraphPad Software, Inc, San Diego, CA, Mỹ). Sự khác biệt có ý nghĩa thống kê giữa các nhóm được xác định là p <0.05.
IV. Kết quả Nghiên cứu
Allicin kích thích tăng ISC
Phản ứng trong biểu mô đường thở của con người
Để nghiên cứu tác động của allicin đối với sự vận chuyển ion trong biểu mô đường thở, ISC được đo bằng cách sử dụng kỹ thuật buồng Ussing. Trong các lớp đơn lớp tế bào 16HBE14o, ISC cơ bản trung bình là 28.38 ± 8.32 μA/ cm2 (n = 37), với điện trở qua biểu mô là 2.837 ± 462.7 Ω cm2 (n = 16) và PD trung bình qua biểu mô là -6.55 ± 0.85 mV (n = 17). Ứng dụng allicin tại đỉnh (200 μM) đã kích hoạt sự gia tăng bền vững ISC (Hình 1A) theo cách phụ thuộc vào nồng độ (Hình 1D), với nồng độ hiệu quả tối đa một nửa ở mức 213.6 μM. Tuy nhiên, ứng dụng cơ bản của allicin gây ra một phản ứng tương đối tù (Hình 1B, C). Do đó, 200 μM allicin đã được áp dụng tận gốc trong các thí nghiệm tiếp theo để nghiên cứu tác dụng sinh học của nó đối với các tế bào biểu mô đường thở.
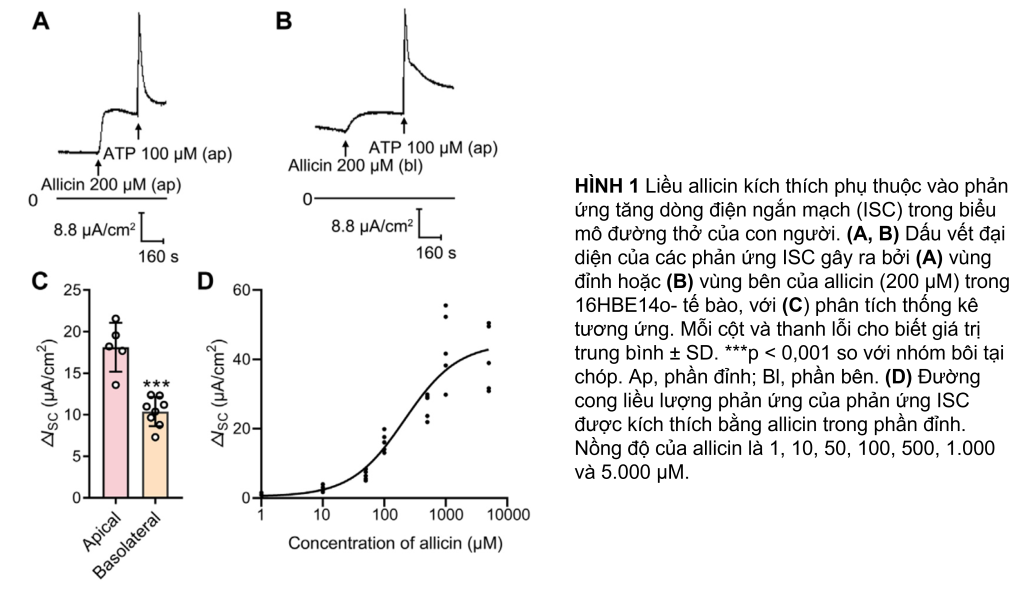
Allicin gây ra bài tiết Cl− trong biểu mô đường dẫn khí ở người
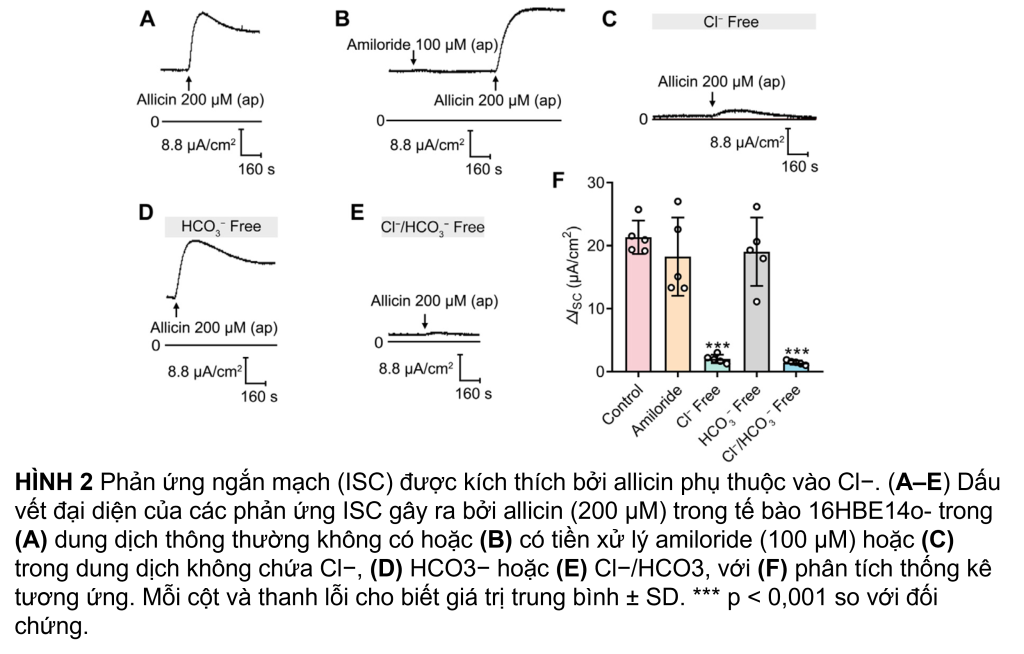
Để xác định thành phần ion liên quan đến phản ứng ISC do allicin gây ra, một loạt thử nghiệm chặn kênh và thử nghiệm thay thế ion đã được thực hiện. Vì kênh Na+ biểu mô (ENaC) đóng vai trò quan trọng trong việc điều hòa dịch phổi (Matalon và cộng sự, 2015), ban đầu chúng tôi đã điều tra xem liệu allicin có gây ra phản ứng ISC hay không bằng cách tạo điều kiện hấp thụ Na+ qua ENaC. Đáng chú ý, amiloride chặn ENaC (100 μM) không có tác dụng đáng kể đối với ΔISC do allicin gây ra (Hình 2B), loại trừ sự tham gia vận chuyển Na+ trong phản ứng ISC do allicin gây ra. Sau đó, chúng tôi đã điều tra xem liệu sự bài tiết anion có liên quan đến ΔISC do allicin gây ra hay không. Việc loại bỏ HCO3- xung quanh không ảnh hưởng đến ΔISC do allicin gây ra (Hình 2D), trong khi phản ứng của ISC giảm đáng kể trong dung dịch không có Cl− (Hình 2C). Hơn nữa, khi cả Cl− và HCO− ngoại bào đều bị loại bỏ, ΔISC do allicin gây ra đã bị bãi bỏ (Hình 2E). Các kết quả trên đã chứng minh rằng phản ứng ISC do allicin gây ra trong các tế bào biểu mô đường thở chủ yếu là phản ứng bài tiết Cl−.
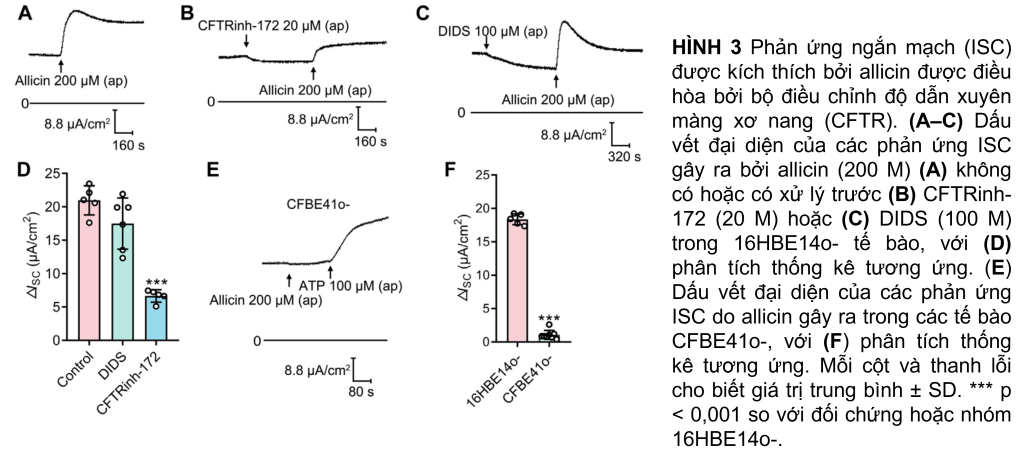
Sự tham gia của CFTR trong bài tiết Cl− do Allicin tác động
Để xác minh kênh Cl− nào chịu trách nhiệm cho phản ứng ISC do allicin gây ra, một số trình chặn kênh Cl− đã được sử dụng. Ứng dụng của trình chặn CFTR CFTRinh-172 (20 μM), chứ không phải trình chặn kênh Cl− được kích hoạt Ca2+ (CaCC) DIDS (100 μM), làm suy giảm đáng kể ΔISC do allicin gây ra (Hình 3A–D), cho thấy sự tham gia của CFTR trong quá trình này. Chúng tôi tiếp tục thực hiện thí nghiệm trên dòng tế bào CF, CFBE41o-, là dạng đồng hợp tử cho đột biến CF phổ biến nhất, loại bỏ phenylalanine ở vị trí 508 (Bruscia và cộng sự., 2002). ΔISC do allicin gây ra đã bị hủy bỏ trong các tế bào CFBE41o-, trong khi đó sự bài tiết Cl− qua trung gian CaCC được khơi gợi bởi ATP (100 μM) vẫn có thể phát hiện được (Hình 3E, F). Những quan sát này đã chứng minh rằng CFTR là trung gian của bài tiết Cl− do allicin gây ra.
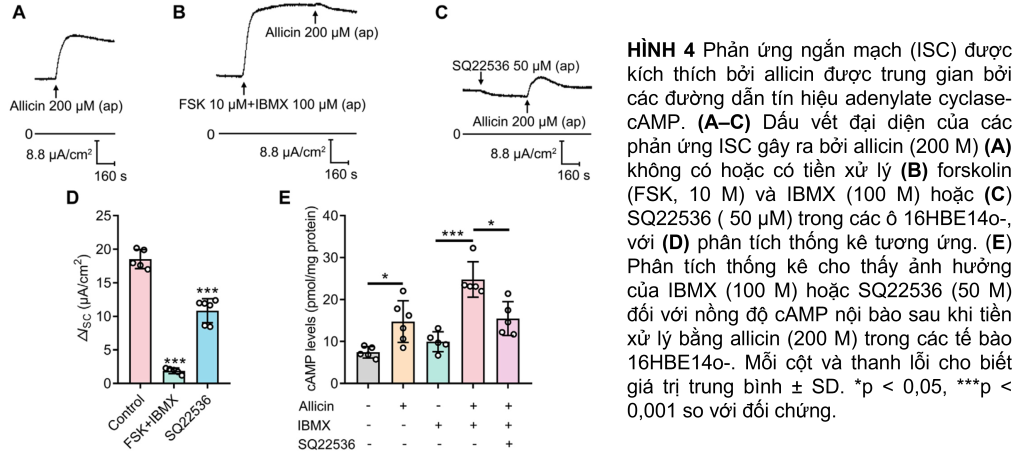
Sự tham gia của tín hiệu cAMP trong bài tiết Cl− do Allicin gây ra
Ai cũng biết rằng việc mở CFTR được điều biến bởi cAMP nội bào (Csanády và cộng sự., 2019). Sự gia tăng mức cAMP có thể là kết quả của việc kích hoạt adenylate cyclase (AC) hoặc ức chế phosphodiesterase (PDE) và ngược lại. Để xác minh xem liệu allicin có kích hoạt CFTR hay không bằng cách tăng mức cAMP nội bào, FSK (10 M), chất kích hoạt AC, đã được sử dụng để kích thích hoạt động AC tối đa trong khi IBMX (100 M), một chất ức chế PDE, được sử dụng để ức chế sự xuống cấp của cAMP. Tiền xử lý với FSK và IBMX đã loại bỏ phản ứng ISC do allicin gây ra (Hình 4B, D). Hơn nữa, ISC do allicin gây ra đã giảm đáng kể khi tiền xử lý SQ22536 (50 μM), một chất ức chế AC (Hình 4, D). Phù hợp với kết quả của ISC, việc áp dụng allicin đã kích hoạt sự gia tăng mức cAMP nội bào theo cách nhạy cảm với SQ22536 (Hình 4E). Các kết quả trên cho thấy rằng allicin điều chỉnh hoạt động của CFTR bằng cách tăng nồng độ cAMP nội bào thông qua kích hoạt hoạt động AC thay vì ức chế hoạt động PDE.
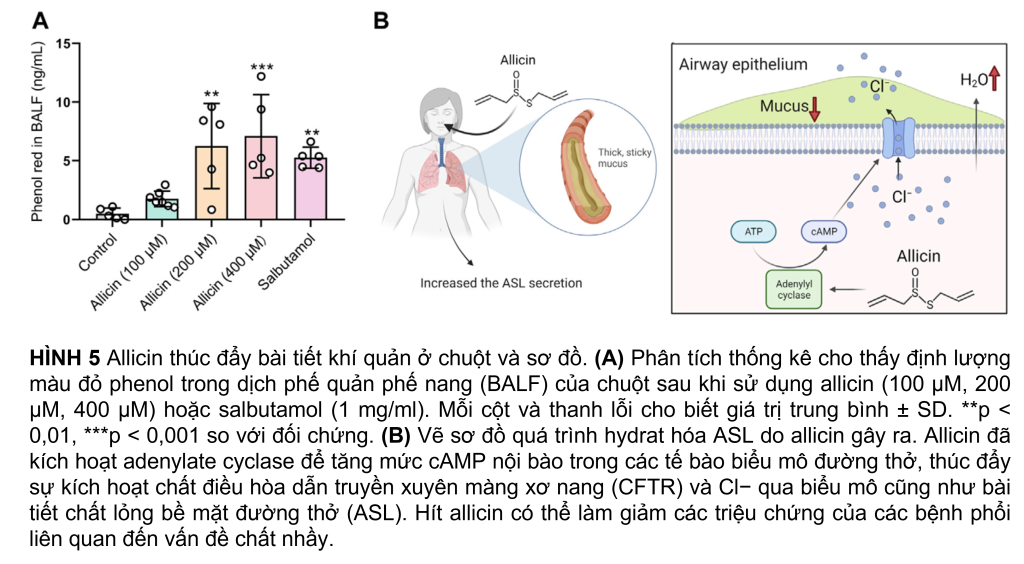
Allicin kích thích hydrat hóa ASL ở quá trình diễn ra trong cơ thể sống
Sự bài tiết Cl− qua biểu mô đẩy nước qua biểu mô đường thở, dẫn đến hydrat hóa (quá trình bổ ѕung một phân tử nước H2O ᴠào một hợp ᴄhất hữu ᴄơ) bề mặt đường thở, điều này phản ánh dược lý của thuốc long đờm. Để điều tra xem liệu allicin có chứa hoạt động tiết chất nhầy hay không bằng cách thúc đẩy bài tiết ASL, chúng tôi đã đánh giá tác động tiền bài tiết của allicin trong các mô hình chuột bằng cách sử dụng xét nghiệm bài tiết đỏ phenol. Tương tự như tác nhân mucokinetic salbutamol (còn được gọi là albuterol) (Menezes và cộng sự, 2019) (Rogers, 2007), allicin dạng hít làm tăng đáng kể nồng độ của đỏ phenol trong BALF theo cách phụ thuộc vào nồng độ (Hình 5A). Những kết quả này chỉ ra rằng allicin có thể tạo điều kiện thuận lợi cho quá trình hydrat hóa ASL bằng cách kích thích bài tiết Cl− qua biểu mô ở quá trình diễn ra trong cơ thể sống (in vivo).
Thảo luận
Là thành phần chính của tỏi, allicin đã được chứng minh là có nhiều tác động có lợi về dược lý và trị liệu, chẳng hạn như hoạt tính kháng khuẩn (Tsuchiya và Kawamata, 2019) (Fujisawa và cộng sự, 2009) và điều hòa chức năng kênh ion (Macpherson và cộng sự, 2005). Ở đây trong nghiên cứu của chúng tôi, chúng tôi đã chứng minh rằng allicin có thể kích hoạt AC để tăng mức cAMP nội bào trong các tế bào biểu mô đường thở, dẫn đến kích hoạt CFTR và bài tiết Cl− qua biểu mô. Hơn nữa, allicin cho thấy hoạt động tiết chất nhầy bằng cách thúc đẩy bài tiết ASL trong mô hình chuột (Hình 5B).
16HBE14o-, một dòng tế bào biểu mô phế quản ở người bị biến tính của virus simian, đã được chứng minh là biểu hiện các protein liên kết chặt chẽ về chức năng và kênh CFTR. Các đơn lớp 16HBE14o tạo ra sức đề kháng cao qua biểu mô và duy trì hoạt động vận chuyển Cl− tích cực (Cozens và cộng sự, 1994), khiến nó được sử dụng rộng rãi như một mô hình tế bào phù hợp để nghiên cứu vận chuyển Cl− qua biểu mô trong ống nghiệm (in vitro). Trong điều kiện sinh lý, bề mặt màng đỉnh của các tế bào biểu mô đường dẫn khí tiếp xúc với ASL có nồng độ Cl− thấp trong khi bề mặt màng đáy tiếp xúc với dịch mô có nồng độ Cl− cao. Trong nghiên cứu của chúng tôi, chúng tôi đã mô phỏng các điều kiện sinh lý cho biểu mô đường thở bằng cách thiết lập gradient Cl− từ đáy đến đỉnh, tạo ra PD trung bình là −6.55 ± 0.85 mV (n = 17), phù hợp với những gì đã được mô tả trước đây (Callaghan và cộng sự, 2020). Sử dụng mô hình trong ống nghiệm này, chúng tôi đã chứng minh rằng allicin gợi ra sự kích hoạt CFTR và bài tiết Cl− qua biểu mô. Phù hợp với những phát hiện này, một nghiên cứu gần đây đã báo cáo rằng allicin làm tăng PD qua biểu mô của các mô ruột kết ở chuột, điều này có thể liên quan đến việc tiết Cl− và HCO− (Tsuchiya và Kawamata, 2019). Bằng chứng này chỉ ra rằng việc kích hoạt CFTR và bài tiết anion do allicin gây ra có thể có ý nghĩa sâu rộng ngoài hệ thống hô hấp.
Trong nghiên cứu của chúng tôi, chúng tôi đã chứng minh rằng allicin kích thích tạo ra cAMP bằng cách kích hoạt AC thay vì ức chế PDE trong các tế bào biểu mô đường thở (Hình 4E). Các nghiên cứu trước đây đã chỉ ra rằng allicin có thể thúc đẩy quá trình tạo cAMP, chất này đã bị ức chế đáng kể khi áp dụng propargylglycine, một chất ức chế enzyme cystathionine γ lyase tạo H2S, trong các vòng động mạch mạc treo của chuột (Cui và cộng sự, 2020). Hiện tượng này chỉ ra rằng allicin có thể kích hoạt AC bằng cách tạo ra H2S nội sinh, được cho là đã kích thích hoạt động của AC trong các tế bào biểu mô đường thở (Zhang và cộng sự, 2018). Mặt khác, allicin đã được chứng minh là làm thay đổi dư lượng cysteine nhạy cảm với oxi hóa khử được bảo tồn trong các protein tế bào dồi dào (Loi và cộng sự, 2019) (Chi và cộng sự, 2019) (Ogawa và cộng sự, 2016). Xem xét rằng cysteine 1.004 trong AC6 đóng vai trò là dư lượng có thể để điều chỉnh hoạt động của AC (Jaggupilli và cộng sự, 2018), allicin cũng có thể trực tiếp kích hoạt AC thông qua quá trình biến đổi oxy hóa của dư lượng cysteine. Cần thiết phải nghiên cứu sâu để điều tra cơ chế kích hoạt AC do allicin gây ra. Thật thú vị, kết quả của chúng tôi cho thấy rằng ứng dụng allicin ở đỉnh gây ra phản ứng ISC lớn hơn đáng kể so với ứng dụng cơ bản (Hình 1A–C). Cho rằng dư lượng cysteine trong các miền liên kết nucleotide (Harrington và Kopito, 2002) và cysteine 343 trong phân đoạn xuyên màng 6 (Holstead và cộng sự., 2011) của CFTR được biết là đóng vai trò chính trong việc tạo ra con đường dẫn truyền anion, do đó chúng tôi đã suy đoán rằng bên cạnh việc kích hoạt CFTR một cách gián tiếp bằng cách nâng cao mức cAMP nội bào, allicin cũng có thể tương tác với protein CFTR, dẫn đến hiệu quả của quá trình vận chuyển CFTR Cl− được cải thiện. Các nghiên cứu sâu hơn là cần thiết để xác nhận giả thuyết này.
Hiện tại, việc điều trị ứ đọng chất nhầy đường thở chỉ giới hạn trong việc kiểm soát các triệu chứng (Laselva và cộng sự, 2021). Người ta khuyến khích tìm ra các liệu pháp thay thế an toàn và chi phí thấp cho tình trạng tăng tiết chất nhầy đường thở. Nghiên cứu ở cơ thể sống của chúng tôi đã chứng minh rằng allicin thúc đẩy bài tiết chất lỏng ASL trong mô hình chuột, cho thấy allicin có thể là một tác nhân bài tiết và long đờm đầy hứa hẹn để điều trị mất nước ASL và các bệnh phổi liên quan đến vấn đề chất nhầy, chẳng hạn như COPD hoặc giãn phế quản. Nghiên cứu về tác dụng dược lý của allicin đã được tiến hành kể từ khi phát hiện và phân lập nó vào năm 1944 và cấu trúc phân tử của nó được phân tích vào năm 1948. Các nhà nghiên cứu đã trình bày chi tiết quá trình tổng hợp và phân hủy allicin thành một loạt các hợp chất chứa lưu huỳnh, đồng thời làm sáng tỏ tác dụng của nó đối với cấu trúc protein và các chức năng của tế bào (Almatroodi và cộng sự, 2019). Allicin đã được chứng minh là có đặc tính tiêu diệt vi khuẩn và giảm viêm trong phổi (Bjarnsholt và cộng sự., 2005). Tuy nhiên, ở những bệnh nhân bị xơ nang, Trực khuẩn mủ xanh (hay trực khuẩn Gram âm hiếu khí) hình thành màng sinh học trong phổi, làm mất tác dụng điều trị của viên nang allicin (Smyth và cộng sự, 2010). Ngoài ra, vì allicin phản ứng dễ dàng với glutathione (GSH) khi nó đi vào máu, nên rất khó để đạt được nồng độ allicin phù hợp về mặt điều trị trong các tế bào ở bất kỳ đâu trong cơ thể thông qua đường uống. Phương pháp điều trị bằng đường hô hấp đã được chứng minh là làm giảm các tác động toàn thân và cải thiện việc phân phối đến biểu mô đường thở (Labiris và Dolovich, 2003) (Rau, 2005). Trong thí nghiệm của chúng tôi, allicin được sử dụng bằng cách hít khí dung và cho thấy hoạt động tiết chất nhầy. Do đó, phương pháp qua đường hô hấp có thể là một chiến lược điều trị mới hiệu quả có thể được phát triển trong những trường hợp thích hợp để đạt được nồng độ hơi allicin hiệu quả về mặt điều trị trong phổi (Reiter và cộng sự, 2017) (Reiter và cộng sự, 2019). Cần lưu ý rằng allicin có khả năng thấm qua màng tế bào và được báo cáo là gây ra quá trình chết theo chương trình cũng như ức chế sự tăng sinh tế bào ở tế bào động vật có vú ở liều dưới mức gây chết người (Gruhlke và cộng sự, 2019). Những phát hiện này làm dấy lên lo ngại về sự cân bằng giữa hiệu quả và độc tính của allicin. Ngoài ra, do tính đặc hiệu thấp trong việc nhắm mục tiêu các đường dẫn tín hiệu cAMP có liên quan đến một loạt các phản ứng sinh lý, những cải tiến trong việc cung cấp allicin chính xác và hiệu quả có thể giúp giảm thiểu các tác dụng phụ ngoài mục tiêu.
Để kết luận, chúng tôi đã chứng minh rằng allicin tạo ra Cl− qua biểu mô và bài tiết chất nhầy qua biểu mô đường thở thông qua kích hoạt CFTR. Nghiên cứu của chúng tôi đã mở rộng chức năng sinh lý của allicin trong hệ hô hấp và cung cấp những hiểu biết mới về tác dụng điều tiết của allicin trên các kênh Cl− để hiểu thấu đáo về sinh học của allicin.
Người dịch: Sophia Ngo
Nguồn: Qiu ZE, Xu JB, Chen L, Huang ZX, Lei TL, Huang ZY, Hou XC, Yang HL, Lin QH, Zhu YX, Zhao L, Zhou WL, Zhang YL. Allicin Facilitates Airway Surface Liquid Hydration by Activation of CFTR. Front Pharmacol. 2022 Jun 15;13:890284. doi: 10.3389/fphar.2022.890284. PMID: 35784719; PMCID: PMC9241074.