>> Tìm hiểu thêm về chùm bài nghiên cứu việc sử dụng tỏi để hỗ trợ điều trị COVID-19: tỏi & COVID-19 Archives – Book Hunter
Tóm lược
Allicin (diallyl thiosulfinate) là hợp chất organosulfur phản ứng thiol chính được sản sinh từ cây tỏi (Allium sativum) khi mô cây bị tổn thương. Allicin thể hiện hoạt tính kháng khuẩn mạnh mẽ, chống lại vi khuẩn và nấm thông qua quá trình S-thioallyl hóa của các thiol protein và thiol trọng lượng phân tử thấp. Ở nghiên cứu này, chúng tôi đã nghiên cứu tác động của allicin đối với các tế bào Vero E6 và Calu-3 bị nhiễm SARS-CoV-2. Các xét nghiệm độc tính cho thấy các tế bào Calu-3 thể hiện khả năng chịu đựng allicin cao hơn, có thể là do mức GSH cao hơn >4 lần so với các tế bào Vero E6 rất nhạy cảm. Sự tiếp xúc của các tế bào Vero E6 và Calu-3 bị nhiễm bệnh với liều allicin tương thích sinh học dẫn đến giảm ∼60–70% RNA của virus và các hạt virus truyền nhiễm. Protein định lượng không có nhãn được sử dụng để điều tra những thay đổi trong hệ protein Calu-3 sau khi nhiễm SARS-CoV-2 và tác dụng của allicin đối với hệ protein của virus chủ. Sự lây nhiễm SARS-CoV-2 của các tế bào Calu-3 đã gây ra sự cảm ứng mạnh mẽ của dấu hiệu gen kích thích interferon (ISG) kháng virus, bao gồm một số tác nhân chống virus, chẳng hạn như cGAS, Mx1, IFIT, IFIH, IFI16, IFI44, OAS và ISG15, con đường vận chuyển nang nước, các mối nối chặt chẽ (KIF5A/B/C, OSBPL2, CLTCL1 và ARHGAP17) và sửa đổi ubiquitin (UBE2L3/5), cũng như lập trình lại quá trình chuyển hóa, phiên mã và dịch mã của vật chủ. Việc xử lý bằng allicin đối với các tế bào Calu-3 bị nhiễm bệnh đã làm giảm biểu hiện của các đường truyền tín hiệu IFN và các bộ lọc ISG, đồng thời chuyển một số đường dẫn của vật chủ về mức độ của các tế bào không bị nhiễm bệnh. Allicin tiếp tục làm giảm sự phong phú của các protein virus cấu trúc N, M, S và ORF3 trong hệ protein của virus vật chủ. Tóm lại, dữ liệu của chúng tôi chứng minh hoạt động điều hòa miễn dịch và kháng virus của liều allicin tương thích sinh học trong môi trường nuôi cấy tế bào bị nhiễm SARS-CoV-2. Nghiên cứu về thuốc trong tương lai nên được hướng tới việc khai thác khả năng phản ứng thiol của các dẫn xuất allicin với tính ổn định tăng lên và độc tính tế bào người thấp hơn dưới dạng các hợp chất khởi nguồn kháng virus.
I. Tổng quan về SARS-CoV-2 và Allicin có trong Tỏi
Hội chứng hô hấp cấp tính nặng do virus corona 2 (SARS-CoV-2) gây ra virus corona (COVID-19), dẫn đến gánh nặng cho sức khỏe toàn cầu (Zhou và cộng sự, 2020). COVID-19 thường liên quan đến bệnh lý miễn dịch vì những bệnh nhân bị bệnh nặng đã giảm mức độ tế bào lympho T, bao gồm tế bào T điều hòa, tế bào T gây độc tế bào và hỗ trợ cũng như tế bào tiêu diệt tự nhiên (Qin và cộng sự, 2020; Wei và cộng sự, 2020). Những bệnh nhân bị bệnh nặng có hội chứng bão cytokine liên quan đến tình trạng kích hoạt miễn dịch bị điều hòa và quá trình viêm (Fara và cộng sự, 2020). Mức độ cao của các cytokine gây viêm IL-1ß, IL-2, IL-6, IL-7, IL-10, protein gây viêm đại thực bào -1A (MIP-1A), TNF-α và INF-γ đã được phát hiện, mối liên hệ giữa tình trạng viêm không kiểm soát được và rối loạn điều hòa phản ứng miễn dịch với tỷ lệ tử vong cao ở bệnh nhân COVID-19 bị bệnh nặng (Fara và cộng sự, 2020; Qin và cộng sự, 2020; Wei và cộng sự, 2020). Trong khi các bệnh nhiễm trùng nhẹ được đặc trưng bởi các tế bào đơn nhân gây viêm HLA-DRhiCD11chi được kích hoạt cao với dấu hiệu gen kích thích interferon (ISG), bệnh nặng được biểu hiện bằng các tiền chất bạch cầu trung tính bị rối loạn chức năng và các tế bào đơn nhân HLA-DRlo có chức năng tiền viêm (Schulte-Schrepping và cộng sự, 2020). Các dấu hiệu miễn dịch của các cytokine tiền viêm và khoang tủy bị rối loạn chức năng có thể giúp xác định các mục tiêu dùng thuốc để ngăn chặn sự tiến triển thành bệnh nặng (Fara và cộng sự, 2020; Schulte-Schrepping và cộng sự, 2020).
Trong khi các chiến dịch tiêm chủng toàn cầu đang được tiến hành, việc phát triển các liệu pháp hiệu quả để ngăn chặn sự tiến triển của bệnh COVID-19 là một nhu cầu cấp thiết. Cây tỏi (Allium sativum) tạo ra các hợp chất organosulfur dễ bay hơi, chẳng hạn như diallyl thiosulfinate (allicin) và diallyl polysulfanes, được biết đến với tác dụng kháng khuẩn, kháng virus, chống ung thư, chống viêm và điều hòa miễn dịch (Borlinghaus và cộng sự, 2014, 2021; Schäfer và Kaschula, 2014). Các hợp chất trong tỏi cho thấy hoạt tính kháng khuẩn phổ rộng chống lại một số vi khuẩn gây bệnh, virus, nấm và ký sinh trùng (Rabinkov và cộng sự, 1998; Münchberg và cộng sự, 2007; Block, 2010; Borlinghaus và cộng sự, 2014, 2021; Reiter và cộng sự, 2017; Arbach và cộng sự, 2019; Loi và cộng sự, 2019; Rouf và cộng sự, 2020).
Allicin là một hợp chất phản ứng thiol, phản ứng với Cys thiol thông qua phản ứng trao đổi thiol-disulfide, dẫn đến S-thioallyl hóa protein (Miron et al., 2000, 2010). Sự phân bố rộng rãi S-thioallyl của dư lượng Cys nhạy cảm với oxi hóa khử trong protein đã được xác định trong hệ protein của tế bào Jurkat ở người, Escherichia coli, Staphylococcus aureus và Bacillus subtilis (Rabinkov và cộng sự, 1998; Miron và cộng sự., 2010; Müller và cộng sự., 2016; Chi và cộng sự, 2019; Gruhlke và cộng sự, 2019; Loi và cộng sự, 2019). Trong các tế bào ung thư Jurkat, 332 protein S-thioallyl hóa đã được xác định 10 phút sau khi điều trị bằng allicin, bao gồm các protein khung tế bào rất dồi dào, chaperone HSP90, các yếu tố kéo dài dịch mã và enzyme glycolytic. Allicin gây ra sự gián đoạn khung tế bào actin, bất hoạt enzym và giải phóng Zn2+ để kích thích tế bào T tiết ra IL-2 phụ thuộc IL-1 như một tác dụng điều hòa miễn dịch (Gruhlke và cộng sự, 2019).
Ngoài ra, S-thioallylations làm cạn kiệt các thiol trọng lượng phân tử thấp, chẳng hạn như glutathione (GSH) và bacillithiol (BSH) trong tế bào vi khuẩn và nấm men (Gruhlke và cộng sự, 2010, 2019; Arbach và cộng sự, 2019). Do đó, allicin dẫn đến phản ứng căng thẳng oxy hóa, ức chế chức năng protein và cân bằng oxy hóa khử tế bào bị suy yếu. Vì SARS-CoV-2 rất giàu dư lượng Cys trong glycoprotein tăng đột biến trên bề mặt của nó, nên tế bào chất của tế bào chủ cần phải ở trạng thái giảm để virus xâm nhập và hợp nhất màng hiệu quả. Hơn nữa, allicin có khả năng thấm qua tế bào và đã được chứng minh là gây ra sự hình thành kẽ thoáng qua trong màng phospholipid (Miron và cộng sự, 2000; Gruhlke và cộng sự, 2015). Tác dụng kháng virus của allicin trước đây đã được nghiên cứu đối với một số loại virus đường hô hấp, bao gồm cúm, SARS-CoV và rhinovirus (Rouf và cộng sự., 2020).
Trong nghiên cứu này, chúng tôi chỉ ra rằng allicin ở liều tương thích sinh học làm giảm các hạt virus truyền nhiễm và RNA virus của SARS-CoV-2 trong dòng tế bào Vero E6 có nguồn gốc từ thận của loài linh trưởng và dòng tế bào Calu-3 phổi của con người. Chúng tôi đã xác định thêm những thay đổi về hệ protein do nhiễm SARS-CoV-2 gây ra và tác dụng của allicin đối với các con đường của vật chủ này. Trong khi dấu hiệu gen kích thích interferon (ISG) được điều hòa nổi bật nhất trong các tế bào Calu-3 bị nhiễm SARS-CoV-2, thì phản ứng ISG và một số con đường của tế bào chủ đã được allicin khôi phục về mức độ của các tế bào chưa được xử lý. Do đó, allicin có tác dụng kháng virus và điều hòa miễn dịch khi áp dụng trong môi trường nuôi cấy tế bào bị nhiễm bệnh trong ống nghiệm, được hỗ trợ ở cấp độ hệ protein.
II. Nguyên liệu và Phương pháp Thử nghiệm
Nuôi cấy các dòng tế bào và thử nghiệm lây nhiễm với các dòng tế bào SARS-CoV-2
Vero E6 (ATCC CRL-1586) và Calu-3 (ATCC HTB-55) được nuôi cấy trong môi trường Modified Eagle’s Medium (DMEM) của Dulbecco, được bổ sung 10% huyết thanh bào thai bò (FBS), 1% axit amin không thiết yếu và 1% natri pyruvate (Gibco), và phát triển ở 37°C và 5% CO2. Các dòng tế bào không có mycoplasma, được xác thực dựa trên đặc tính hình thái và tăng trưởng và được xác nhận bằng PCR. Nuôi cấy tế bào được sử dụng cho các thử nghiệm về khả năng sống sót hoặc nhiễm trùng bên dưới đoạn tế bào 20. Không có loại kháng sinh nào được sử dụng trong quá trình nuôi cấy tế bào nhân chuẩn.
Các thí nghiệm lây nhiễm được thực hiện với SARS-CoV-2 phân lập ở Munich (CSpecVir985) trong điều kiện an toàn sinh học cấp 3 với thiết bị bảo vệ cá nhân hô hấp thích hợp. Các tế bào Vero E6 và Calu-3 được gieo tương ứng với mật độ 3,5 × 10⁵ hoặc 6 × 10⁵ tế bào/ml trong các đĩa TC 12 giếng (TPP Techno Plastic Products AG). Sau 24 giờ, các tế bào bị nhiễm ở MOI 0,01 hoặc 0,005, được pha loãng trong môi trường OptiPro không có huyết thanh trong 1 giờ ở 37°C. Môi trường đã được loại bỏ và các tế bào được rửa hai lần bằng dung dịch muối đệm phốt phát (PBS), sau đó bổ sung DMEM và chất bổ sung. Các mẫu được lấy ở 16 và 24 h p.i. để phân tích thêm.
Tổng hợp và điều trị bằng Allicin
Allicin được tổng hợp bằng cách oxy hóa 3-[(Prop-2-en-1-yl)disulfanyl]prop-1-ene (dallyl disulfide, Sigma-Aldrich, Đức) với axit peracetic (glacial acetic acid /H2O2) như mô tả trước đây (Gruhlke và cộng sự, 2010). Để phân tích tác dụng kháng virus của allicin, các thí nghiệm lây nhiễm SARS-CoV-2 đã được thực hiện với allicin trước và sau khi xử lý tế bào Vero E6. Đối với tiền xử lý, tế bào hoặc dịch pha loãng virus được ủ với 50 µM allicin trong 30 phút. Chúng tôi đã chọn 50 µM allicin vì nồng độ này được xác định là gây chết người đối với các tế bào Vero E6. Các tế bào được xử lý trước được rửa bằng PBS và bị nhiễm theo quy trình lây nhiễm như mô tả ở trên. Virus được xử lý trước đã được sử dụng trong thí nghiệm lây nhiễm theo giao thức trên. Quá trình xử lý sau các tế bào bị nhiễm SARS-CoV-2 được thực hiện bằng cách thêm nồng độ allicin được chỉ định vào môi trường sau khi lây nhiễm. Do đó, trong quy trình sau điều trị, allicin được thêm vào vẫn còn trên các tế bào bị nhiễm bệnh cho đến khi lấy mẫu sau 16 và 24 giờ.
Xét nghiệm khả năng sống của tế bào
Khả năng sống của tế bào Vero E6 và tế bào Calu-3 được phân tích bằng cách định lượng mức ATP bằng cách sử dụng Xét nghiệm khả năng sống của tế bào phát quang CellTiter-GloQR (Promega) theo hướng dẫn của nhà sản xuất. Các tế bào được nuôi cấy như mô tả ở trên trong các vi đĩa được xử lý bằng TC màu đen đáy phẳng 96 giếng (CorningQR) và tiếp xúc với các lượng allicin khác nhau trong 24 giờ. Khả năng tồn tại của các tế bào được xử lý đã được chuẩn hóa thành các tế bào không được xử lý.
Xác định mức độ Glutathione và Glutathione Disulfide trong tế bào Vero E6 và Calu-3
Các tế bào Vero E6 và Calu-3 được nuôi cấy như mô tả ở trên trong đĩa nuôi cấy mô đáy phẳng màu trắng đục 96 giếng (Falcon) và được gieo hạt với mật độ 1×10⁴ tế bào/giếng. Sau khi rửa bằng PBS, nồng độ GSH và glutathione disulfide (GSSG) nội bào được xác định bằng cách sử dụng xét nghiệm GSH/GSSG-GloTM (Promega) theo hướng dẫn của nhà sản xuất đối với các tế bào kết dính. Tóm lại, tổng mức GSH được đo trong một mẫu bằng cách giảm GSSG thành GSH bằng DTT. Tổng lượng GSSG được đo trong mẫu thứ hai bằng cách chặn GSH đã giảm bằng N-ethylmaleimide (NEM), sau đó là giảm GSSG bằng DTT. GSH transferase (GST) sử dụng GSH làm đồng sáng lập để chuyển luciferin-NT thành GSH-NT dẫn đến việc giải phóng luciferin. Luciferin bị oxy hóa thành oxyluciferin bởi Ultra-GloTM rLuciferase, dẫn đến phát xạ phát quang hóa học, được đo bằng thời gian tích hợp 1 giây/giếng bằng đầu đọc vi bản CLARIOstar (BMG Labtech). Các mức GSH được tính toán dựa trên các đường cong tiêu chuẩn của GSH. Để xác định mức GSH của tế bào, lượng GSSG đã được trừ vào tổng mức GSH.
Xét nghiệm chuẩn độ mảng bám
Số lượng hạt virus truyền nhiễm được xác định bằng xét nghiệm chuẩn độ mảng bám. Các đơn lớp Vero E6 được cấy vào các đĩa TC 24 giếng (TPP Techno Plastic Products AG) và được nhiễm 200 µl SARS-CoV-2 pha loãng nối tiếp có chứa dịch nổi nuôi cấy tế bào của các tế bào Vero E6 hoặc Calu-3 bị nhiễm, được pha loãng trong Môi trường không có huyết thanh OptiPro. Sau 1 giờ hấp phụ, phần nổi phía trên được loại bỏ và các tế bào được phủ bằng 1,2% Avicel (FMC BioPolymers) được pha loãng trong DMEM. Sau 72 giờ, lớp phủ được loại bỏ, các tế bào được cố định trong 6% formaldehyde và các mảng được hiển thị bằng nhuộm màu tím pha lê.
Trích xuất RNA của virus và PCR phiên mã ngược thời gian thực
Chiết xuất RNA của virus được thực hiện từ 50 μl dịch nổi nuôi cấy của các tế bào Vero E6 và Calu-3 bị nhiễm SARS-CoV-2 bằng cách sử dụng bộ RNA virus (Macherey-Nagel) theo hướng dẫn của nhà sản xuất. Tương đương bộ gen SARS-CoV-2 (GE) đã được phát hiện bằng RT–PCR định lượng [Hệ thống và phần mềm PCR thời gian thực LightCycler 480 phiên bản 1.5 (Roche)], nhắm mục tiêu gen E của SARS-CoV-2 bằng cách sử dụng đoạn mồi E gen-F (5t-ACAGGTACGTTAATAGTTAATAGCGT- 3t) và gen E-R (5t ATATTGCAGCAGTACGCACACA-3t). Quá trình định lượng tuyệt đối được thực hiện bằng cách sử dụng các tiêu chuẩn RNA được phiên mã trong ống nghiệm cụ thể của SARS-CoV-2 như đã mô tả trước đây (Corman và cộng sự, 2020).
Phân tích hệ protein của các tế bào chủ bị nhiễm SARS-CoV-2 bằng phương pháp khối phổ Orbitrap Fusion
6 × 10⁵ tế bào Calu-3 trên mỗi mẫu đã bị nhiễm SARS-CoV-2 như mô tả ở trên và được xử lý bằng 150 µM allicin trong 24 giờ. Tế bào Calu-3 được thu hoạch bằng cách ly tâm. Các viên tế bào được rửa bằng PBS và alkyl hóa trong 15 phút ở nhiệt độ phòng (RT) trong điều kiện biến tính trong 200 µl dung dịch đệm UCE-IAM, bao gồm 8 M urê, 1% (w/v) CHAPS, 1 mM EDTA, 200 mM Tris–HCl pH 8,0 và 100 mM IAM như mô tả (Rossius và cộng sự, 2018). Sau đó, dịch chiết protein alkyl hóa được kết tủa bằng trizol và etanol 96% và rửa bốn lần bằng 1 ml etanol 70%. Các viên protein được phân tách bằng một TRANG SDS ngắn 15% không khử, hoạt động trong 15 phút và được nhuộm màu bằng Colloidal Coomassie Blue. Các phần gel được cắt và tiêu hóa tryptic trong gel như mô tả trước đây (Rossius và cộng sự, 2018). Các peptit đã tách rửa được khử muối bằng vật liệu ZipTip-µC18 (Merck Millipore) và hòa tan trong axit formic 0,1% (v/v) trước khi phân tích LC-MS/MS. Các mẫu peptide của tế bào Calu-3 không bị nhiễm (Mock) và tế bào Calu-3 bị nhiễm SARS-CoV-2 có và không có xử lý allicin đã được phân tích nLC-MS/MS bằng cách sử dụng Orbitrap Fusion (nhà cung cấp thiết bị Khoa học Thermo Fisher Thermo Fisher Scientific) kết hợp với một TriVersa NanoMate (Advion, Ltd.) như đã mô tả trước đây (Kublik và cộng sự, 2016). Việc xác định peptit của hệ protein người và SARS-CoV-2 đã được thực hiện bởi Proteome Discoverer (phiên bản 2.2, Thermo Fisher Thermo Fisher Scientific) bằng cách sử dụng công cụ tìm kiếm SequestHT như đã mô tả (Seidel và cộng sự., 2018). Các protein của người và SARS-CoV-2 được xác định bằng cách tìm kiếm tất cả các phổ MS/MS song song dựa trên cơ sở dữ liệu trình tự protein của bộ gen proteome của con người (20.286 mục nhập) được trích xuất từ bản phát hành UniprotKB 12.7 (UniProt Consortium, Nghiên cứu axit nucleic 2007, 35, D193-197) như cũng như chống lại cơ sở dữ liệu trình tự European Virus Archive Global # 026V-03883. Các peptide được coi là được xác định với độ tin cậy cao với tỷ lệ phát hiện sai mục tiêu là ≤0,01 và với độ tin cậy trung bình là ≤0,05, dựa trên các giá trị q.
Các protein đã xác định được định lượng bằng “Bộ định lượng ion Percursor” được triển khai trong Proteome Discoverer 2.2 dựa trên cường độ cao nhất để ước tính mức độ dư thừa của protein người và SARS-CoV-2 trong các mẫu peptide. Dung sai lỗi đối với các giá trị m/z của ion tiền chất và ion mảnh được đặt tương ứng là 3 ppm và 0,5 Da. Hai vị trí phân tách bị bỏ lỡ đã được cho phép. Quá trình oxy hóa methionine (+15,994915 Da), cysteine carbamidomethylation (+57,021464 Da) và cysteine S-thioallyl hóa bởi allicin (+72,00337 Da đối với C3H5S1) được đặt làm các biến đổi biến thiên. Dữ liệu khối phổ đã được gửi đến ProteomeXchange Consortium thông qua kho lưu trữ của đối tác PRIDE (Perez-Riverol và cộng sự, 2019; Deutsch và cộng sự, 2020) với mã định danh tập dữ liệu PXD024375.
Các phân tích thống kê
Phân tích thống kê các thử nghiệm về khả năng sống của tế bào, các phép đo GSH và GSSG cũng như xác định RNA của virus và các phần tử lây nhiễm đã được thực hiện từ 3–4 bản sao sinh học với 1–3 bản sao kỹ thuật bằng cách sử dụng t-test hai đuôi không ghép đôi của Student cho hai mẫu có phương sai không bằng nhau. Các phân tích proteomics được thực hiện từ 3–4 lần sao chép sinh học với 1–3 lần lặp lại kỹ thuật. Để tính toán số liệu thống kê của dữ liệu proteomics, các giá trị cường độ LFQ của từng mẫu proteomics và mỗi lần xử lý riêng lẻ đã được kiểm tra tính quy phạm bằng cách sử dụng Jarque Bera (thử nghiệm độ nhọn và độ lệch) (Jarque và Bera, 1980) và Anderson Darling (dựa trên Kolmogorov- Smirnov) (Anderson và Darling, 1954). Theo đó, giá trị p để so sánh điều trị theo cặp được tính toán bằng phép Welsh test (kiểm tra t-test hai đầu không ghép đôi của Student đối với hai mẫu có phương sai không bằng nhau và dữ liệu phương sai thay đổi). Giá trị p và mức ý nghĩa được bao gồm trong các chú giải hình và bảng.
III. Kết quả Nghiên cứu
Nồng độ Allicin tương thích sinh học tương quan với mức độ Glutathione nội bào trong các tế bào Vero E6 và Calu-3
Trong khi allicin có nhiều tác dụng tốt cho sức khỏe con người, thì tỏi nghiền cũng độc hại và có hại cho tế bào con người. Tỏi tươi có thể gây tổn thương tế bào và mô nghiêm trọng khi tiếp xúc trực tiếp với tế bào biểu mô và màng nhầy của đường hô hấp và da, chẳng hạn như bỏng tỏi (Bautista và cộng sự, 2005; Al-Qattan, 2009; Vargo và cộng sự, 2017; Hitl và cộng sự, 2021; Muniz và cộng sự, 2021). Do đó, trước tiên chúng tôi đánh giá độc tính của allicin trong các tế bào Calu-3 và Vero E6, được sử dụng ở đây làm mô hình nuôi cấy tế bào để lây nhiễm SARS-CoV-2. Sử dụng các thử nghiệm về khả năng sống của tế bào, liều allicin không gây hại, tương thích sinh học trong các tế bào Calu-3 và Vero E6 đã được xác định. Cả hai dòng tế bào khác nhau rất nhiều về tính nhạy cảm của chúng đối với allicin. Các tế bào Calu-3 cho thấy tỷ lệ khả năng sống sót cao ∼85% sau khi điều trị bằng 200 µM allicin. Ngay cả nồng độ 300 µM allicin cũng chỉ làm giảm không đáng kể tỷ lệ khả thi của các tế bào Calu-3 xuống còn ∼70% (Hình 1A). Việc xử lý các tế bào Vero E6 bằng 75 µM allicin dẫn đến tỷ lệ khả năng sống của tế bào là 84% (Hình 1B), trong khi 150 µM allicin dẫn đến việc tiêu diệt 99% tế bào Vero E6. Do đó, liều allicin tương thích sinh học dưới mức gây chết người được xác định là 50–75 µM trong các tế bào Vero E6 và 100–200 µM trong các tế bào Calu-3 dung nạp hơn.
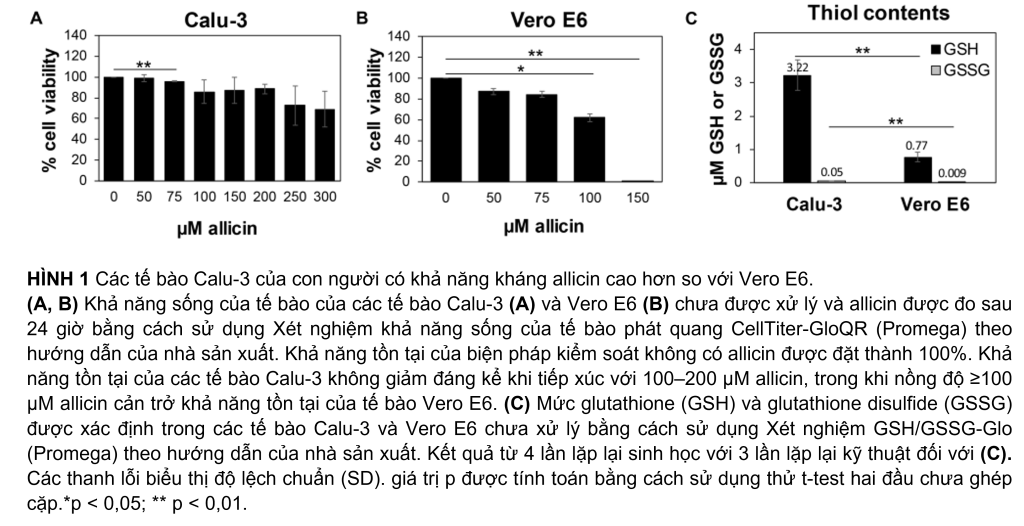
Các nghiên cứu trước đây đã tiết lộ những biến thể mạnh mẽ về tính nhạy cảm của các dòng tế bào khác nhau đối với allicin, tương quan với các hàm lượng GSH nội bào khác nhau (Gruhlke và cộng sự, 2016, 2019). Do đó, chúng tôi đã đo mức GSH và GSSG nội bào trong các tế bào Vero E6 và Calu-3 (Hình 1C). Hàm lượng GSH của các tế bào Calu-3 dung nạp cao hơn được xác định là 3,2 µM, cao hơn 4,2 lần so với chỉ 0,77 µM GSH đo được trong Vero E6. Đúng như dự đoán, lượng GSSG rất thấp với 0,05 µM và 0,009 µM trong các tế bào Calu-3 và Vero E6, tương ứng. Những dữ liệu này cho thấy rằng các tế bào Calu-3 cho thấy khả năng chịu allicin cao hơn một phần là do mức GSH cao hơn so với các tế bào Vero E6.
Allicin dẫn đến giảm các hạt virus truyền nhiễm và RNA virus trong các tế bào Vero E6 và Calu-3 bị nhiễm SARS-CoV-2
Tác dụng kháng virus của allicin đối với SARS-CoV-2 đã được phân tích bằng cách sử dụng các tùy chọn trước và sau điều trị đối với các tế bào Vero E6 bị nhiễm allicin nhạy cảm hơn: (1) Các tế bào đã được tiếp xúc trước với 50 µM allicin trong 30 phút trước khi xảy ra SARS-CoV-2 nhiễm CoV-2. (2) Virus đã được xử lý bằng 50 µM allicin trong 30 phút trước khi lây nhiễm. (3) Các tế bào Vero E6 bị nhiễm SARS-CoV-2 được điều trị bằng 50 µM allicin sau khi phơi nhiễm (p.i.) (Hình 2A). Chúng tôi đã chọn 50 µM allicin vì nồng độ này không ảnh hưởng đến khả năng tồn tại của các tế bào Vero E6 (Hình 1B). Số lượng hạt SARS-CoV-2 truyền nhiễm (PFU, đơn vị hình thành mảng bám) đã được xác định 24h sau phơi nhiễm. bằng xét nghiệm chuẩn độ mảng bám. Tuy nhiên, chỉ sau xử lý với 50 µM allicin đã làm giảm đáng kể 70% số lượng hạt virus truyền nhiễm, trong khi quá trình tiền xử lý tế bào hoặc virus chỉ làm giảm 16–21% mảng vi rút (Hình 2A). Những kết quả này cho thấy rằng allicin có thể ảnh hưởng đến sự tương tác giữa vật chủ và virus bằng các hoạt động điều hòa miễn dịch và kháng virus của nó.
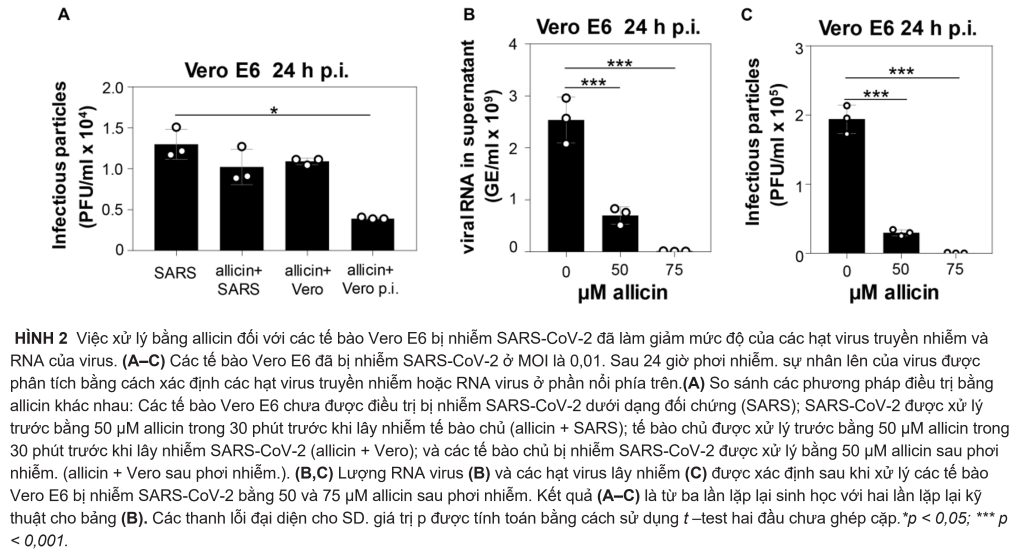
Ngoài ra, tương đương bộ gen RNA của virus (GE) được xác định từ phần nổi phía trên của các tế bào Vero E6 bị nhiễm bằng cách sử dụng RT-PCR định lượng. Phù hợp với các thử nghiệm mảng bám, kết quả qRT-PCR cho thấy lượng RNA virus thấp hơn 72% sau khi bổ sung 50 µM allicin vào các tế bào Vero E6 bị nhiễm SARS-CoV-2 (Hình 2B,C). Ngoài ra, các xét nghiệm mảng bám virus và kết quả qRT-PCR cho thấy khả năng ức chế gần như hoàn toàn >99% sự sao chép của SARS-CoV-2 sau khi tiếp xúc với 75 µM allicin, hỗ trợ hoạt động kháng virus mạnh của allicin trong các tế bào Vero E6 bị nhiễm bệnh (Hình 2B,C).
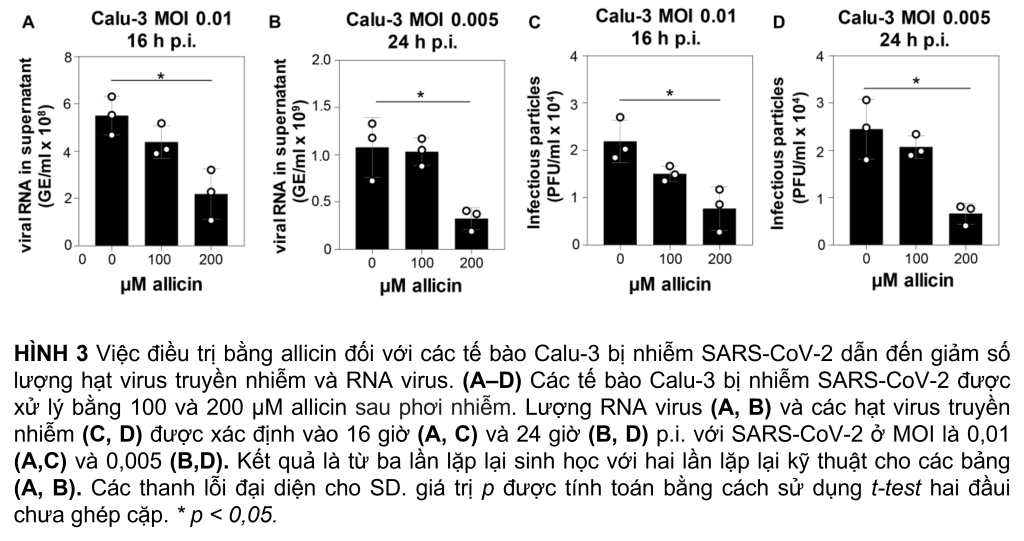
Tác dụng kháng virus của liều allicin tương thích sinh học đã được phân tích sâu hơn trong các tế bào Calu-3 kháng allicin hơn. Sau khi lây nhiễm SARS-CoV-2 ở bội số lây nhiễm (MOI) là 0,01 và 0,005, các tế bào Calu-3 được xử lý bằng các liều tương thích sinh học là 100 và 200 µM allicin và được phân tích lần lượt là 16 và 24 h pi (Hình 3). Điều trị các tế bào Calu-3 bị nhiễm bằng 100 µM allicin không ức chế đáng kể sự nhân lên của virus (Hình 3A–D). Tuy nhiên, việc các tế bào Calu-3 bị nhiễm tiếp xúc với 200 µM allicin dẫn đến giảm đáng kể >60% RNA của virus (Hình 3A, B) và giảm >65% các hạt lây nhiễm (Hình 3, D).
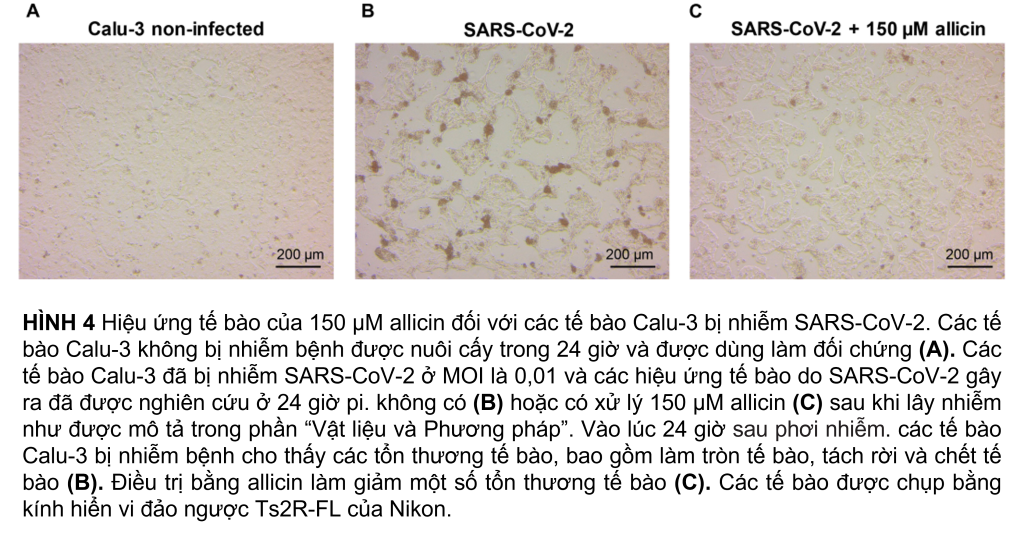
Tác động kháng virus của allicin đối với các tế bào Calu-3 bị nhiễm SARS-CoV-2 được hỗ trợ thêm bằng hình ảnh kính hiển vi (Hình 4A–C). Mặc dù nhiễm SARS-CoV-2 ở MOI 0,01 dẫn đến tổn thương tế bào của tế bào Calu-3 sau 24 giờ phơi nhiễm, nhưng việc bổ sung 150 µM allicin đã bảo vệ một phần tế bào khỏi tổn thương này (Hình 4B,C). Kết hợp lại với nhau, kết quả của chúng tôi chỉ ra rằng liều allicin tương thích sinh học có tác dụng kháng virus chống lại SARS-CoV-2 ở cả tế bào Vero E6 và Calu-3.
Những thay đổi trong hệ protein Calu-3 sau khi nhiễm SARS-CoV-2
Protein định lượng không nhãn (LFQ) bằng phân tích Orbitrap Fusion LC-MS/MS đã được sử dụng để nghiên cứu những thay đổi trong hệ protein của tế bào Calu-3 sau khi nhiễm SARS-CoV-2 và tác dụng của 150 µM allicin. Nồng độ 150 µM allicin đã được chọn vì đây là nồng độ gây chết phụ đối với các tế bào Calu-3 (Hình 1A) và bảo vệ các tế bào khỏi tác hại của SARS-CoV-2 (Hình 4C). Các mẫu proteome của tế bào Calu-3 đã được phân tích trước khi lây nhiễm (Mock) và 24h sau phơi nhiễm với SARS-CoV-2 ở MOI là 0,01 khi không có hoặc có mặt 150 µM allicin trong 3–4 lần lặp lại sinh học và 1–3 lần lặp lại kỹ thuật. Tổng cường độ LFQ của tất cả các protein trong mỗi mẫu đã được chuẩn hóa và chiếm 100% tổng lượng protein dồi dào. Nhìn chung, chúng tôi đã định lượng được 4.251 protein, bao gồm 4.243 protein chủ Calu-3 và 8 protein SARS-CoV-2 trong tổng số protein (Bảng bổ trợ 1,2). Sau khi bị lây nhiễm, khoảng 207 và 329 protein lần lượt bị giảm ≥1,5 lần và giảm <0,66 lần (Bảng bổ trợ 3). 536 protein được biểu hiện khác nhau này chỉ đóng góp 2,73% tổng lượng protein dư thừa trong các tế bào Calu-3 bị nhiễm SARS-CoV-2 (Bảng bổ sung 3). Các protein được sắp xếp thành các loại KEGG Onology (KO) hoặc Uniprot và các thay đổi về nếp gấp, giá trị p và độ dư thừa trung bình của chúng được hiển thị trong sơ đồ cây Voronoi dưới dạng độ dốc màu và kích thước ô tương ứng (Hình 5A, D và Bảng bổ sung 3). Một tập hợp con của các protein được cảm ứng mạnh nhất trong hệ protein Calu-3 sau khi nhiễm SARS-CoV-2 được liệt kê trong Bảng 1.
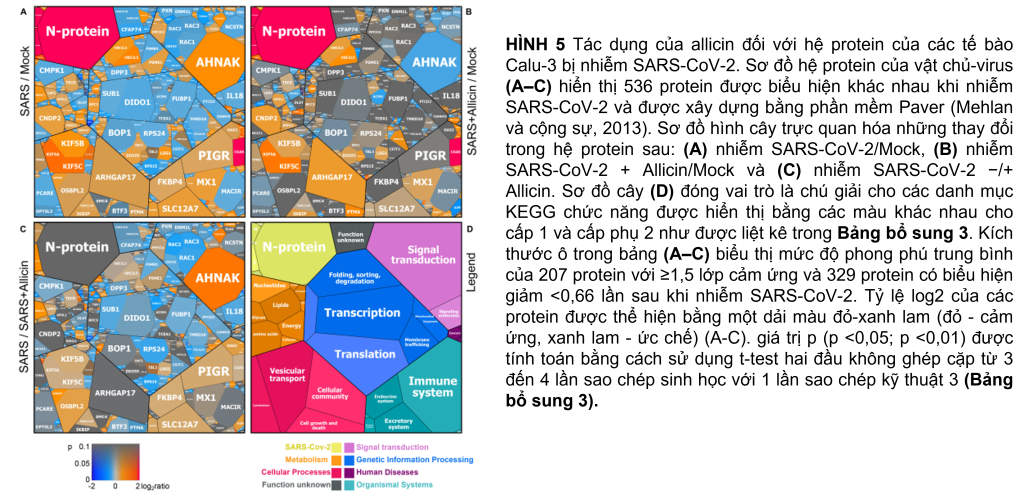
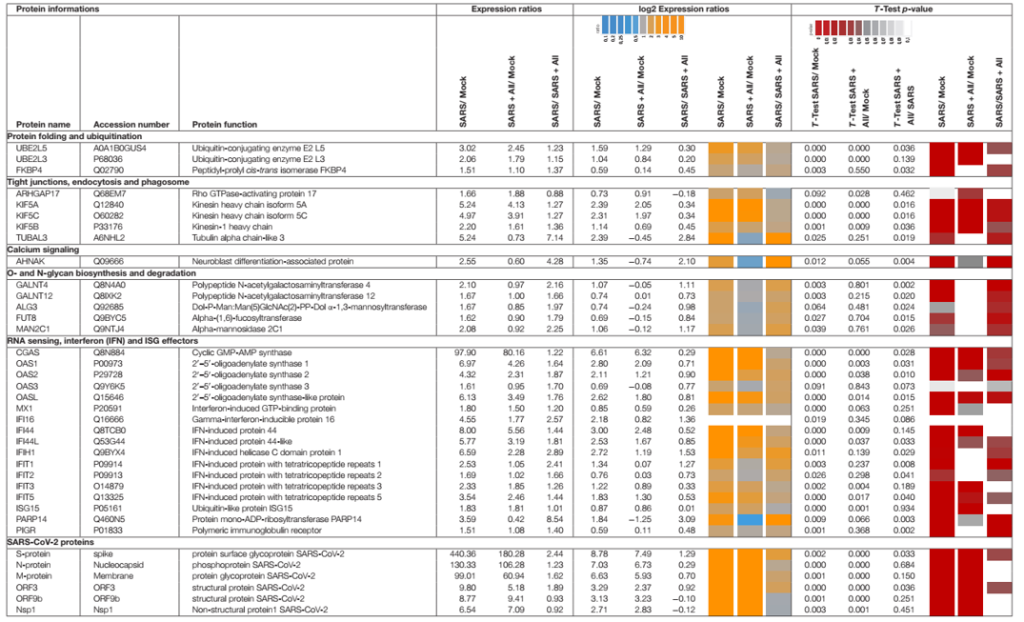
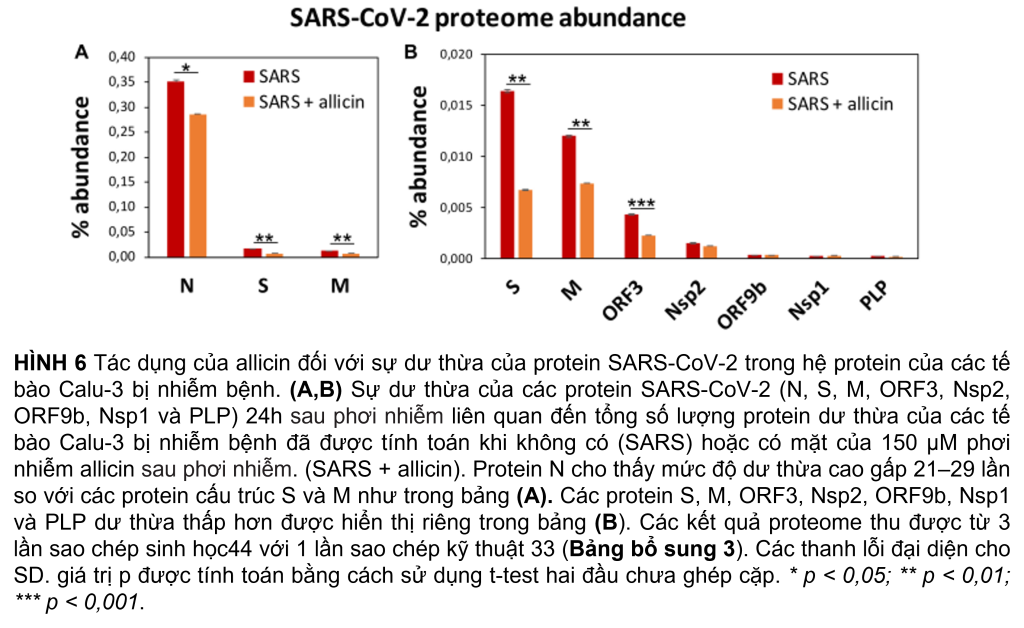
Hệ protein sau khi nhiễm SARS-CoV-2 cho thấy sự thay đổi biểu hiện của các con đường tế bào khác nhau, bao gồm dấu hiệu gen được kích thích bằng interferon (ISG), phiên mã, dịch mã và thoái hóa protein, khung tế bào, vận chuyển nang nước và các mối nối chặt chẽ, tế bào chết theo chương trình (apoptosis), con đường truyền tín hiệu cũng như chuyển hóa carbon, lipid và nucleotide (Hình 5A, Bảng 1 và Bảng bổ sung 3). Ngoài ra, tám protein SARS-CoV-2 được phát hiện đã được tạo ra sau 24 giờ phơi nhiễm của các tế bào Calu-3, với protein ribonucleocapsid (N-protein) là một trong những protein dư thừa nhất trong hệ protein của các tế bào Calu-3 bị nhiễm với 0,35% tổng số protein. Protein N được biểu thị cao hơn 29 và 21 lần so với protein màng (M-protein) (0,012%) và protein gai (S-protein) (0,016%), tương ứng (Hình 6A và Bảng bổ sung 3), xác nhận dữ liệu trước đó với các tế bào Vero E6 bị nhiễm virus (Zecha và cộng sự, 2020). Các protein virut Nsp1, Nsp2, ORF3, ORF9b và protease giống papain PLP có số lượng thấp, đóng góp từ 0,00022% (PLP) đến 0,0043% (ORF3) vào tổng số protein (Hình 6B và Bảng bổ trợ 3), trong khi các protein khác protein virus không được phát hiện.
Các coronavirus SARS đã được chứng minh là xâm nhập vào tế bào thông qua quá trình nhập bào và dung hợp trực tiếp với màng tế bào (Wang và cộng sự, 2008; Ou và cộng sự, 2020). Cùng quan điểm với các báo cáo này, 18 protein liên quan đến vận chuyển nang nước và điều hòa khung tế bào, chẳng hạn như sự hình thành lysosome, thể thực bào và exosome được biểu hiện cao hơn 1,5–5,2 lần sau khi lây nhiễm trong hệ protein Calu-3 (Hình 5A, Bảng 1, và Bảng bổ sung 3). Trong số các protein này có các kinesin (KIF5A/B/C), clathrin (CLTCL1) và tubulin (TUBAL3) phong phú và được cảm ứng cao, là các protein liên kết với vi ống và tham gia vào quá trình nội tiết và lưu thông RNA và túi của virus. Protein kích hoạt Rho GTPase 17 (ARHGAP17) dồi dào gấp 1,7 lần có thể tham gia vào việc sửa chữa các mối nối chặt chẽ, thường bị tổn thương ở bệnh nhân COVID-19 (De Maio và cộng sự, 2020; Tian và cộng sự, 2020).
Khoảng 21 protein của phản ứng interferon (IFN) và ISG đã được kích hoạt mạnh mẽ, bao gồm các cảm biến của RNA virus, đường dẫn truyền tín hiệu JAK-STAT và các tác nhân kháng virus can thiệp vào vòng đời của virus (Hình 5A, Bảng 1 và Bảng bổ sung 3) (Schneider và cộng sự, 2014). Để hiểu rõ hơn, các thụ thể cảm nhận RNA, tầng tín hiệu IFN và ISG và các chức năng chống virus được mô tả trước đây của bộ kích hoạt ISG được hiển thị trong sơ đồ (Hình 7A, B). Enzyme tổng hợp GMP-AMP (cGAMP) theo chu kỳ (cGAS) được điều chỉnh mạnh nhất gấp 98 lần khi bị nhiễm trùng, đóng vai trò là cảm biến của RNA virus (Bảng 1, Bảng bổ sung 3 và Hình 5A) (Schneider và cộng sự, 2014). cGAMP kích hoạt bộ phận kích thích các gen interferon (STING) (Hình 7A).
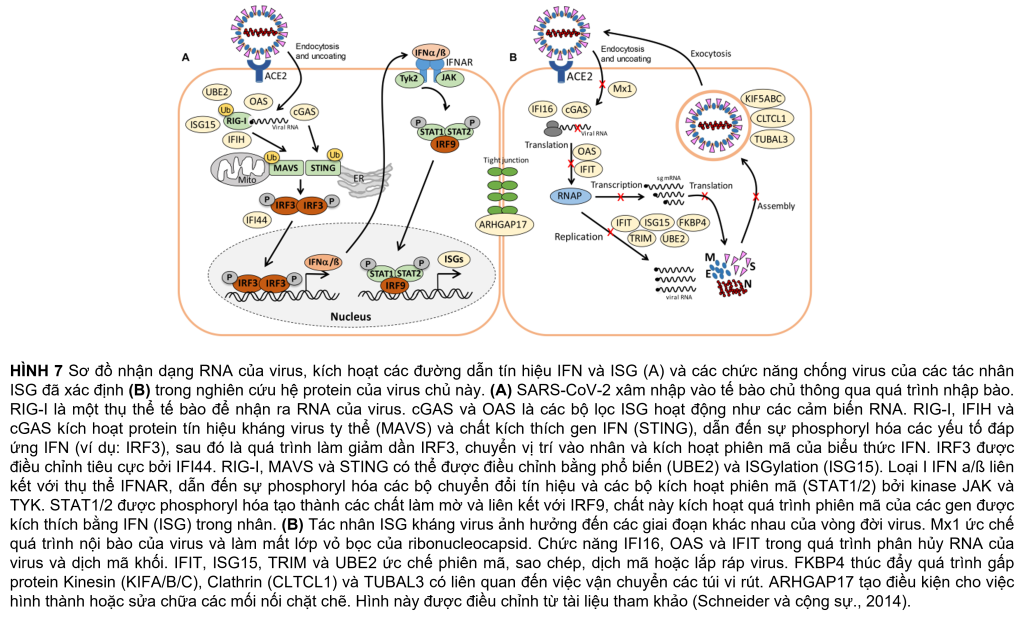
Các chất tổng hợp 2t-5t-oligoadenylate (OAS1-3, OASL) được tạo ra gấp 1,6–7 lần khi bị nhiễm trùng để tạo ra axit 2t-5t-adenylic làm chất truyền tin thứ hai và chất kích hoạt RNaseL cho quá trình thoái biến RNA của virus. Protein chứa miền C helicase do IFN gây ra (IFIH) được điều chỉnh tăng gấp 6,5 lần, kích hoạt protein báo hiệu kháng vi-rút ty thể (MAVS) để tạo ra phản ứng IFN. Các protein hiệu ứng khác do IFN gây ra có lặp lại tetratricopeptide (IFIT1-3, IFIT5) được tạo ra gấp 1,6–3,5 lần sau khi lây nhiễm và có chức năng phân hủy RNA và ức chế dịch mã. Các tác nhân khác là protein kháng myxoma do Interferon gây ra 1 (MX1) và thụ thể globulin miễn dịch Polyme (PIGR), chiếm 0,05 và 0,1% tổng lượng proteome phong phú và lần lượt là 1,8 và 1,5 lần. MX1 là một GTPase giống như thuốc nổ, tạo thành các cấu trúc dạng vòng và bẫy các ribonucleocapsid sắp đến, do đó ngăn chặn quá trình bóc vỏ và buôn bán dạng nang nước để hướng chúng xuống cấp (Hình 7B) (Schneider và cộng sự, 2014). MX1 cũng được báo cáo là tăng cường điều chỉnh ở bệnh nhân COVID-19 (Bizzotto và cộng sự, 2020).
Hơn nữa, cytokine IL18 dư thừa, protein đối kháng thụ thể IL-1 (IL1RN), chất điều hòa chuyển hóa miễn dịch đại thực bào MACIR và Alpha-2- macroglobulin (A2M) thấp hơn ∼0,6 lần biểu hiện trong các tế bào bị nhiễm bệnh. MACIR có liên quan đến việc điều chỉnh các đại thực bào và các bệnh tự miễn dịch (McGauran và cộng sự, 2020).
Vai trò quan trọng trong việc truyền tín hiệu và điều chỉnh phản ứng kháng virus đóng vai trò tác nhân ISG15 dư thừa, được tạo ra gấp 1,8 lần sau khi nhiễm SARS-CoV-2 trong hệ protein. ISG15 hoạt động cùng với các chức năng khác dưới dạng công cụ sửa đổi giống Ubiquitin trong ISGylation của RIG-I và IRF-3, được nhắm mục tiêu cho sự xuống cấp hoặc được kích hoạt để điều chỉnh quá trình sản xuất IFN và ISG (Hình 7A) (Masucci, 2020). ISGylation phát tán các protein virus mới được tổng hợp được đề xuất để ức chế sự sao chép và dịch mã của virus (Durfee và cộng sự., 2010).
Ngoài ra, sửa đổi sau dịch mã bằng cách đa dạng hóa các yếu tố tín hiệu của vật chủ, chẳng hạn như RIG-I, STING và MAVS là rất quan trọng để điều chỉnh phản ứng IFN khi nhiễm SARS-CoV-2 (Hình 7A). Do đó, một số enzyme E2 liên hợp ubiquitin (UBE2L3 và UBE2L5), ubiquitin ligases E3 ubiquitin (TRIM21, TRIM38 và ARIH2) và protease hoặc deconjugase đặc hiệu ubiquitin (USP13) gấp 1,5 lần 3,2 lần trong các tế bào bị nhiễm, trong khi các loại khác Enzyme E2, E3 và deconjugase (ví dụ: UBE2D2/3, RNF214, USP4, USP47 và USP48) được biểu thị thấp hơn 0,2–0,62 lần (Bảng 1, Bảng bổ sung 3 và Hình 5A). Do các mục tiêu phổ biến của vật chủ và virus của quá trình phổ biến và ISGylation thường hướng đến sự thoái hóa, nên các thành phần của proteasome, protease, các yếu tố cuộn gập protein và chaperones được điều chỉnh gấp 1,5–1,8 lần. Các yếu tố cuộn gập bao gồm peptidyl-prolyl cis-trans isomerase FKBP4 rất phong phú, có chức năng như immunophilin và co-chaperone để tương tác với HSP90.
Ngoài việc biến đổi protein, virus còn dựa vào quá trình tổng hợp và dịch mã protein của bộ máy chủ để sao chép và lây nhiễm thành công. Theo đó, 24 protein liên quan đến quá trình dịch mã đã được điều hòa tăng gấp 1,5–2,8 lần khi nhiễm SARS-CoV-2, bao gồm yếu tố dịch mã EIF2B1, protein ribosome (RPL26, MRPS30, RRP8, PDCD11 và MRPL4), chuỗi xoắn RNA (DDX55 và DDX56) , RNAses (POP1 và XRN1) và các yếu tố điều tiết khác, chẳng hạn như phosphatase (PPP1CC, PPP1CA và PPP2R5A) (Bảng bổ sung 3 và Hình 5A).
Ngoài ra, 16 protein liên quan đến phiên mã và spliceosome được điều hòa tăng cường trong các tế bào Calu-3 bị nhiễm, bao gồm các yếu tố nối tiền mRNA Slu7, PRPF40B, SCAF11 và ribonucleoprotein C (SNRPC) hạt nhân nhỏ U1, có kích thước cao hơn 1,6–1,8 lần. Các yếu tố phiên mã GABPA, ZNF579, SP110 và TSC22D2 cũng được tạo ra sau khi lây nhiễm. Tuy nhiên, phần lớn các protein được biểu hiện khác biệt liên quan đến phiên mã (48) và dịch mã (30) đã bị ức chế sau khi nhiễm SARS-CoV-2, bao gồm các protein dư thừa DIDO1, SUB1, FUBP1, TCEA1, BOP1, RPS24 và RPS15 (Bổ sung Bảng 3 và Hình 5A).
Hơn nữa, sự sao chép và tăng sinh của virus bên trong tế bào chủ đòi hỏi phải lập trình lại quá trình chuyển hóa của vật chủ, điều này thể hiện rõ qua sự điều hòa tăng của 34 protein và điều hòa giảm 43 protein liên quan chủ yếu đến chuyển hóa lipid, năng lượng, glycan và nucleotide (Bảng 1, Bảng bổ sung 3, và Hình 5A). Các protein cảm ứng có thể hoạt động trong quá trình sinh tổng hợp các khối xây dựng cho màng phospholipid của virus, quá trình glycosyl hóa protein bề mặt và bộ gen RNA của virus. Vì nhóm nucleotide rất cần thiết cho sự sao chép của coronavirus (Bojkova và cộng sự, 2020), nên một số protein sinh tổng hợp purine và pyrimidine được cảm ứng gấp 1,7–2,3 lần (NT5C2, UPP1 và PPAT), trong khi những protein khác bị ức chế 0,5-0,65 lần (CMPK1, AK6 và ENPP4) (Bảng bổ sung 3 và Hình 5A).
Ngoài ra, sự biểu hiện của một số đường dẫn tín hiệu, bao gồm tín hiệu JAK-STAT, MAPK, Wnt, Ras và Rap1 đã bị ảnh hưởng khi lây nhiễm SARS-CoV-2. Con đường JAK-STAT cảm nhận và truyền tín hiệu IFN thông qua một tầng phosphoryl hóa để kích hoạt biểu hiện ISG (Hình 7A). Do đó, NMI tương tác STAT2, N-myc và thụ thể RIG-I là 1,6–1,8 lần gây ra khi nhiễm trùng (Bảng bổ trợ 3 và Hình 5A). Các protein của đường dẫn tín hiệu MAPK đã được kích hoạt để đáp ứng với sự lây nhiễm SARS-CoV (Bouhaddou và cộng sự, 2020) và 1,6–1,8 lần được tạo ra trong hệ protein của các tế bào bị nhiễm SARS-CoV-2. Các protein của con đường truyền tín hiệu PI3K/Akt được điều hòa tăng gấp 2,3–2,6 lần trong các tế bào bị nhiễm bệnh, kiểm soát quá trình chết theo chương trình của tế bào chủ để sao chép virus thành công. Protein AHNAK liên quan đến biệt hóa nguyên bào thần kinh rất phong phú đã được tạo ra gấp 2,6 lần sau khi nhiễm SARS-CoV-2. AHNAK cần thiết cho tín hiệu canxi và có thể điều chỉnh phản ứng miễn dịch (Matza và cộng sự, 2009). Các protein của con đường truyền tín hiệu Ras được điều hòa giảm 0,5-0,64 lần khi nhiễm virus, bao gồm ba Rac GTPase Rac1-3 có liên quan đến việc điều chỉnh hình thái tế bào, di chuyển và xâm lấn, bằng cách truyền tín hiệu từ các thụ thể bề mặt tế bào sang actin và khung tế bào vi ống (Wheeler và cộng sự., 2006). Tương tự, các protein khác liên quan đến tổ chức khung tế bào được biểu thị thấp hơn 0,3–0,66 lần, cho thấy sự tái tổ chức của khung tế bào để vận chuyển các hạt virus.
Allicin dẫn đến giảm phản ứng interferon kháng virus trong hệ protein của các tế bào Calu-3 bị nhiễm bệnh
Tiếp theo, chúng tôi đã nghiên cứu tác động của allicin đối với những thay đổi của hệ protein khi nhiễm SARS-CoV-2. Định lượng 8 protein virus trong các tế bào Calu-3 bị nhiễm sau khi điều trị bằng allicin cho thấy lượng protein cấu trúc N, M, và ORF3 giảm đáng kể 18–59%, hỗ trợ tác dụng kháng virus của allicin trong hệ protein (Hình 6A, B).
Việc điều trị bằng allicin làm giảm phản ứng với IFN trong các tế bào bị nhiễm bệnh, do sự biểu hiện của các thụ thể miễn dịch bẩm sinh và các tác nhân ISG của các đường truyền tín hiệu JAK-STAT đã giảm, bao gồm FKBP4, PIGR, MX1, cGAS, OAS1-3 và IFIT1-3 (Bảng 1, Bảng bổ sung 3 và Hình 5B, C). Ngoài ra, các protein liên quan đến quá trình phổ biến (UBE2L3/5) và các lộ trình truyền tín hiệu JAK-STAT, MAPK, PI3K/Akt và Ras cho thấy sự thay đổi biểu hiện thấp hơn sau khi điều trị bằng allicin. Protein tín hiệu canxi dồi dào AHNAK đã bị ức chế sau khi tiếp xúc với allicin, trong khi nó được tạo ra trong các tế bào bị nhiễm bệnh. Allicin dẫn đến giảm biểu hiện của kinesin KIFA/B/C, clathrin CLTCL1 và tubulin TUBAL3, cho thấy giảm nội bào và lưu lượng của các nang nước. Hơn nữa, prothymosin alpha (PTMA) được điều chỉnh gấp 2,6 lần sau khi tiếp xúc với allicin. PTMA cho thấy hoạt động kháng virus để ức chế sự nhân lên của virus gây thiếu máu loại 1 ở người (Mosoian và cộng sự., 2006; Teixeira và cộng sự., 2015), cho thấy rằng cảm ứng PTMA bởi allicin có thể góp phần vào tác dụng kháng virus chống lại SARS-CoV-2.
Tương tự, sự biểu hiện của các protein liên quan đến phiên mã, spliceosome và dịch mã đã bị đảo ngược về mức độ của các tế bào không bị nhiễm (Mock) sau khi tiếp xúc với allicin của các tế bào bị nhiễm SARS-CoV-2, bao gồm các protein dư thừa DIDO1, SUB1, FUBP1, TCEA1, BOP1, RPS24 và RPS15. Cuối cùng, sự biểu hiện của các enzym chuyển hóa liên quan đến chuyển hóa glycan, nucleotide và lipid đã được phục hồi nhờ allicin, bao gồm GALNT4/12, ALG3, FUT8, MAN2C1, CMPK1 và TECR (Bảng 1, Bảng bổ trợ 3 và Hình 5B, C). Nhìn chung, allicin cho thấy tác dụng kháng virus trong hệ protein của vật chủ như được tiết lộ bởi phản ứng kháng virus phụ thuộc vào IFN giảm dần và các tác động đối với quá trình truyền tín hiệu, phiên mã, dịch mã và chuyển hóa.
IV. Thảo luận về Nghiên cứu tác động của Allicin có trong Tỏi đối với SARS-CoV-2
Các hợp chất organosulfur trong tỏi cho thấy hoạt động kháng virus chống lại một số loại virus có vỏ bọc, bao gồm herpes simplex, parainfluenza, vaccinia và rhovirus (Weber và cộng sự, 1992; Rouf và cộng sự, 2020). Tác dụng diệt virut này của các hợp chất trong tỏi được đề xuất là phụ thuộc vào sự phá vỡ vỏ bọc của virus và ức chế sự nhân lên của virus (Weber và cộng sự, 1992; Rouf và cộng sự, 2020).
Trong nghiên cứu này, chúng tôi đã khám phá tác dụng kháng virus của allicin đối với các tế bào Vero E6 và Calu-3 bị nhiễm SARS-CoV-2. Bằng cách xác định mức giảm >60–70% của RNA virus và các phần tử virus lây nhiễm, tác dụng kháng virus của liều allicin tương thích sinh học đối với SARS-CoV-2 đã được chứng minh ở cả hai dòng tế bào. Tuy nhiên, các tế bào Calu-3 cho thấy khả năng dung nạp allicin cao hơn so với các tế bào Vero E6 nhạy cảm hơn. Các dòng tế bào khác nhau trước đây đã được chứng minh là khác nhau về tính nhạy cảm với allicin, tương quan với mức GSH nội bào của chúng (Gruhlke và cộng sự, 2016, 2019). Allicin dẫn đến S-thioallyl hóa GSH và hình thành S-allylmercaptoglutathione (GSSA), đi kèm với sự suy giảm GSH và sự thay đổi oxy hóa trong thế oxy hóa khử của GSH (Gruhlke và cộng sự, 2010, 2019; Müller và cộng sự, 2016 ). Phép đo mức GSH đã xác nhận rằng các tế bào Calu-3 có mức GSH cao hơn 4,2 lần so với các tế bào Vero E6 nhạy cảm với allicin.
Do các tế bào Vero E6 nhạy cảm hơn với allicin so với các tế bào Calu-3, nên trước tiên chúng tôi đã phân tích tác động của allicin ở mức độ thấp 50 µM đối với các tế bào Vero E6 bị nhiễm SARS-CoV-2 bằng cách sử dụng phương pháp điều trị trước và sau khi lây nhiễm tế bào chủ hoặc tiếp xúc trước với virus trước khi lây nhiễm. Điều thú vị là, việc xử lý các tế bào Vero E6 bằng 50 µM allicin chỉ cho thấy tác dụng kháng virus nếu được áp dụng sau khi bị nhiễm SARS-CoV-2. Số lượng hạt virus lây nhiễm không bị ảnh hưởng nếu virus hoặc tế bào chủ Vero E6 được xử lý trước bằng 50 µM allicin trong 30 phút trước khi lây nhiễm. Tác dụng kháng virus bị thiếu này của allicin trong các thí nghiệm tiền xử lý có thể được giải thích bằng bước rửa tế bào Vero E6 sau khi lây nhiễm 1 giờ, dẫn đến việc loại bỏ allicin còn lại khỏi tế bào. Trong quá trình xử lý sau nhiễm trùng, allicin vẫn còn trong tế bào nuôi cấy cho đến khi thu hoạch mẫu. Những kết quả này cho thấy rằng allicin có thể phá vỡ các bước đầu tiên của quá trình nhân lên của virus trong các tế bào Vero E6, điều này cần được nghiên cứu thêm. Các thí nghiệm tiếp theo cho thấy sự giảm đáng kể các mảng virus và bản sao RNA ở cả hai dòng tế bào Vero E6 và Calu-3 bị nhiễm SARS-CoV-2 sau khi tiếp xúc với allicin sau phơi nhiễm.
Để hiểu rõ hơn về tác dụng của allicin, chúng tôi đã nghiên cứu sự thay đổi của hệ protein của tế bào Calu-3 khi nhiễm SARS-CoV-2 và tác động của 150 µM allicin đối với hệ protein của vi rút chủ. Phù hợp với các nghiên cứu về hệ protein trước đây, SARS-CoV-2 lập trình lại các con đường chính của vật chủ, bao gồm các con đường truyền tín hiệu, phiên mã, nối, dịch mã, biến đổi và gấp protein, chuyển hóa lipid, glycan và nucleotide (Bảng 1, Bảng bổ trợ 3 và Hình 5A, 7A,B) (Bojkova và cộng sự, 2020; Bouhaddou và cộng sự, 2020; Zecha và cộng sự, 2020). Protein ribonucleocapsid là protein virus phong phú nhất trong tế bào bị nhiễm bệnh, cho thấy rằng một phần lớn khả năng dịch mã được chuyển đến protein N để đóng gói bộ gen RNA của virus.
Ngoài ra, dữ liệu hệ protein của chúng tôi nêu bật tầm quan trọng của con đường IFN và các tác nhân ISG để ngăn chặn sự nhân lên của vi rút bằng cách tương tác với các giai đoạn khác nhau trong vòng đời của vi rút. Các tác nhân ISG kháng virus nằm trong số các protein phong phú và được cảm ứng cao nhất trong các tế bào chủ bị nhiễm, chẳng hạn như MX1, cGAS, OAS1-3, IFIT1-3, ISG15, FKBP4, PIGR và UBE2L3/5, có chức năng cảm nhận và phân hủy của RNA của virus, ức chế quá trình tách vỏ ribonucleocapsid, dịch mã và thúc đẩy phản ứng miễn dịch bẩm sinh (Bảng 1, Bảng bổ trợ 3 và Hình 5A, 7A, B). Ngoài tín hiệu IFN, các protein liên quan đến sự vận động, mối nối chặt chẽ và vận chuyển túi màng là những protein chủ được tạo ra cao, hỗ trợ tầm quan trọng của việc vận chuyển nang nước đối với quá trình nội tiết và ngoại bào của virus. Do đó, các nghiên cứu về proteomics của chúng tôi phản ánh tất cả các con đường vật chủ được mô tả đã biết là bị thay đổi sau khi nhiễm virus, gợi ý các mục tiêu vật chủ mới cho các biện pháp can thiệp với SARS-CoV-2.
Đồng thời, tổng khả năng mã hóa protein của bộ gen đã tạo cơ hội để theo dõi phản ứng của các tế bào Calu-3 bị nhiễm bệnh sau khi điều trị bằng allicin. Kết quả hệ protein của các tế bào chủ bị nhiễm allicin được xử lý cho thấy lượng protein cấu trúc N, M, S và ORF3 giảm 18-59%. Một số thay đổi biểu hiện dành riêng cho sự phát triển của virus được đảo ngược thành mức Giả lập trong các tế bào được xử lý bằng allicin. Allicin ảnh hưởng đến biểu hiện phản ứng với virus của các con đường truyền tín hiệu JAK-STAT, MAPK, PI3K/Akt và Ras, IFN và ISG effectors, phiên mã, ghép nối, dịch mã, phổ biến, vận chuyển bọng nước, liên kết chặt chẽ cũng như chuyển hóa glycan, lipid và nucleotide. Do đó, kết quả của chúng tôi xác nhận tác dụng kháng virus của allicin trong tế bào chủ phù hợp với các xét nghiệm lây nhiễm.
Phương thức hoạt động của allicin liên quan đến quá trình S-thioallyl hóa protein và thiol trọng lượng phân tử thấp ở vi khuẩn và tế bào Jurkat của con người, đã được quan sát thấy sau 10–30 phút sau khi xử lý allicin (Gruhlke và cộng sự, 2019; Loi và cộng sự, 2019) . Phần lớn các protein Jurkat được S-thioallyl hóa là các protein tế bào phong phú, tham gia vào khung tế bào, dịch mã và gấp nếp protein, mặc dù các yếu tố phiên mã nhạy cảm với oxi hóa khử cũng có lượng thấp, chẳng hạn như MgrA, SarZ, OhrR, HypR và YodB là mục tiêu để sửa đổi allicin. trong tế bào S. aureus và B. subtilis (Chi và cộng sự, 2019; Gruhlke và cộng sự, 2019; Loi và cộng sự, 2019). Trong nghiên cứu này, chúng tôi không phát hiện thấy các peptide Cys S-thioallyl hóa trong các tế bào Calu-3 bị nhiễm SARS-CoV-2 sau 24 giờ tiếp xúc với allicin bằng cách sử dụng proteomics không nhãn và xác minh phổ MS/MS. Ngoài ra, không có peptide Cys-thioallyl hóa virus nào được xác định, mặc dù protein tăng đột biến là một glycoprotein giàu Cys lộ ra trên bề mặt của lớp vỏ virus (Ou và cộng sự, 2020). Với thời gian điều trị allicin dài, điều này không có gì đáng ngạc nhiên vì các tế bào có khả năng giảm allicin và phần lớn S-thioallyl hóa trong vòng 24 giờ. Trong các tế bào Jurkat của con người, allicin dẫn đến sự cạn kiệt nhanh chóng của nhóm GSH của tế bào trong vòng 10 phút (Gruhlke và cộng sự, 2019). Giải độc allicin hiệu quả và loại bỏ S-thioallylations đã được xác nhận trong tế bào nấm men và vi khuẩn, nhờ sự phục hồi nhanh chóng của quá trình tăng trưởng sau một giai đoạn trễ ngắn do allicin gây ra (Gruhlke và cộng sự, 2010, 2019; Müller và cộng sự, 2016; Loi và cộng sự, 2019). Ở S.aureus, allicin có thể bị khử bởi MerA disulfide reductase, trong khi bacillithiol disulfide reductase YpdA cho phép tái chế S-allylmercaptobacillithiol, được hình thành trong phản ứng của BSH với allicin (Loi và cộng sự, 2019). Hơn nữa, YpdA đã được chứng minh là hoạt động theo con đường Brx/BSH/YpdA trong việc tái tạo protein S-thioallyl hóa (Loi và cộng sự, 2019). Tương tự như vậy, các tế bào Calu-3 lẽ ra phải khử GSSA thông qua glutathione disulfide reductase và các protein S-thioallyl hóa bởi hệ thống glutaredoxin/GSH/glutathione disulfide reductase trong vòng 24 giờ.
Cuối cùng, xuất hiện nghi vấn về cơ chế kháng virus của allicin trên các tế bào Calu-3 bị nhiễm SARS-CoV-2 trong quá trình tương tác giữa vật chủ và mầm bệnh. Các hợp chất organosulfur trong tỏi đã được chứng minh là có tác dụng điều hòa miễn dịch thông qua việc ức chế yếu tố phiên mã NF-κB, dẫn đến giảm mức độ của các cytokine tiền viêm, chẳng hạn như TNF-α, IL-1β, IL-6, MCP-1 và IL -12 (Arreola và cộng sự, 2015). Allicin tiếp tục kích thích giải phóng Zn2+ từ protein trong tế bào T EL-4 ở chuột, có thể là do quá trình S-thioallyl hóa các thiolate Cys phối hợp Zn2+ (Gruhlke và cộng sự, 2019). Do đó, tác dụng điều hòa miễn dịch của allicin đối với sự bài tiết cytokine trong nuôi cấy tế bào có thể được trung gian bởi nồng độ Zn2+ tăng cao do quá trình khử S-thioallylation của protein chủ gây bất hoạt.
Mặt khác, allicin cũng có thể nhắm mục tiêu các protein virus chứa Cys, chẳng hạn như glycoprotein tăng đột biến giàu Cys, RNA polymerase phụ thuộc RNA của vi rút RdRp (Nsp12), protease chính Mpro (còn được gọi là protease giống 3C) và protease giống như papain PLP. Mpro và PLP đều tham gia vào quá trình xử lý phân giải protein của các polyprotein pp1a và pp1ab lớn để tạo ra các polypeptide chức năng, các polypeptide này tập hợp thành phức hợp sao chép-phiên mã (Jin và cộng sự, 2020; Zhang và cộng sự, 2020; Amin và cộng sự, 2021 ). Vì Mpro và RdRp rất quan trọng đối với sự sao chép và tái tạo của virus nên đây có thể là mục tiêu của thuốc kháng virus. Mpro có mô típ vị trí hoạt động xúc tác bao gồm các gốc His41 và Cys145 (Jin và cộng sự, 2020; Zhang và cộng sự, 2020; Amin và cộng sự, 2021). Một số nghiên cứu về kết nối silico với allicin cho thấy sự hình thành của S-thioallylations tại Cys145, Cys85 và Cys156 của Mpro và Cys622 của RdRp, cho thấy tiềm năng của allicin làm giảm sự sao chép của SARS-CoV-2 (Bastikar và cộng sự, 2020; Shekh và cộng sự, 2020). Các nghiên cứu kết nối sâu hơn với các hợp chất tỏi alliin và ajoene cho thấy tính ổn định liên kết phối tử-protein mạnh và nhiều tương tác tại vị trí hoạt động của Mpro (Bstikar et al., 2020; Cheng và Li, 2020). Tổng cộng, 17 hợp chất organosulfur trong tỏi, chiếm 99,4% các chất được tìm thấy trong dầu tỏi, cho thấy sự tương tác với thụ thể ACE2 và Mpro trong silico, bao gồm cả diallyl di- và trisulfide với điểm kết nối đầy hứa hẹn (Thuy và cộng sự, 2020). Hơn nữa, nồng độ Zn2+ tăng cao được giải phóng từ các protein của vật chủ đã ức chế RdRp của virus corona SARS (te Velthuis và cộng sự, 2010) và enzyme ACE2 của vật chủ (Polak và Speth, 2021), cho thấy rằng allicin có thể nhắm mục tiêu trực tiếp vào protein của vật chủ và virut thông qua S-thioallylation hoặc thông qua nồng độ Zn2+ tăng cao để phát huy tác dụng điều hòa miễn dịch và kháng virus.
Do đó, allicin có thể ức chế lây nhiễm SARS-CoV-2 ở các giai đoạn khác nhau trong vòng đời của vi rút, ngăn chặn sự liên kết, sao chép hoặc phiên mã của thụ thể bằng cách S-thioallyl hóa protein của vật chủ hoặc vi rút. Tuy nhiên, trong hệ protein vi-rút vật chủ của chúng tôi, chúng tôi không thể xác định được các protein Mpro hoặc RdRp, cho thấy đây là những protein có hàm lượng phong phú thấp. Do đó, các S-thioallylations có thể có của Mpro và RdRp sẽ khó xác minh khi tiếp xúc với allicin của các tế bào chủ bị nhiễm in vivo. Tuy nhiên, những nghiên cứu về lắp ghép silico này làm nổi bật tiềm năng của các hợp chất organosulfur trong tỏi với vai trò là chất ức chế protein Cys của vi rút, có thể được phát triển thêm như các phương pháp điều trị COVID-19 trong tương lai.
Kết hợp lại với nhau, kết quả của chúng tôi chứng minh rằng allicin thể hiện hoạt tính điều hòa miễn dịch và kháng virus trong môi trường nuôi cấy tế bào Vero E6 và Calu-3 bị nhiễm SARS-CoV-2, được hỗ trợ ở cấp độ hệ protein nhờ phản ứng interferon kháng virus giảm. Tuy nhiên, allicin không ổn định và nhanh chóng bị phân hủy thành polysulfanes, ajoene và các hợp chất lưu huỳnh khác trong quá trình đun nóng (Block, 2010; Borlinghaus et al., 2021). Thời gian bán hủy của allicin là 30–40 ngày trong nước ở 23°C, nhưng giảm trong chiết xuất tỏi với nồng độ tăng (Koch và Lawson, 1996). Trong dạ dày có tính axit, phần lớn allicin bị phân hủy thành 2-propenethiol và allyl methyl sulfide, được bài tiết ra ngoài (Block, 2010; Borlinghaus et al., 2021). Trong máu, liều hiệu quả của allicin bị giảm do phản ứng của nó với GSH (Block, 2010; Borlinghaus và cộng sự, 2021). Trong các thí nghiệm của chúng tôi, tải lượng virus chỉ giảm 60–70% sau khi điều trị bằng allicin trong các tế bào Calu-3, thấp hơn thang đo 1-log và sẽ không đáp ứng hiệu quả kháng virus mong muốn cần thiết cho phương pháp trị liệu để đưa vào thử nghiệm tiền lâm sàng. Các nghiên cứu về thuốc trong tương lai nên được định hướng để khai thác hoạt động phản ứng thiol của các dẫn xuất allicin với khả năng giảm độc tính, tăng tính ổn định và hoạt tính kháng virus cao hơn dưới dạng các hợp chất khởi nguồn về kháng virus.
Người dịch: Sophia Ngo
Nguồn: Mösbauer K, Fritsch VN, Adrian L, Bernhardt J, Gruhlke MCH, Slusarenko AJ, Niemeyer D, Antelmann H. The Effect of Allicin on the Proteome of SARS-CoV-2 Infected Calu-3 Cells. Front Microbiol. 2021 Oct 28;12:746795. doi: 10.3389/fmicb.2021.746795. PMID: 34777295; PMCID: PMC8581659.