Tóm tắt
Một số hormone đường ruột[1] điều chỉnh sự thèm ăn làm thay đổi các hành vi liên quan đến sự mãn nguyện, lo lắng/ tâm trạng, trí nhớ và chức năng nhận thức, mặc dù đối với một số loại hormone này (đặc biệt là GLP-1 và CCK), tín hiệu nội sinh có thể có nguồn gốc từ thần kinh trung ương. Từ góc độ sinh lý, có vẻ như những hormone này, mà sự bài tiết của chúng bị thay đổi bởi tình trạng dinh dưỡng và bằng cách phẫu thuật giảm cân, tạo ra các hiệu ứng sinh học thần kinh được tích hợp và liên quan đến việc kiểm soát ăn uống/ trao đổi chất.
Phù hợp với vai trò trong cơn đói và khai vị trong bữa ăn, trong các bài kiểm tra lo lắng mà nếu không có sẽ cản trở động vật tìm thức ăn thì ghrelin làm tăng hành vi có động cơ đối với thức ăn và làm giảm các hành vi khi thức ăn không có sẵn. Trong số nhiều tín hiệu gây chán ăn, GLP-1 và PYY có liên quan đến chức năng mãn nguyện bị ức chế và CCK (và có thể cả GLP-1) làm tăng hành vi giống như lo lắng.
Giới thiệu
Mối quan tâm đến tín hiệu của ruột-não đã giảm dần trong những năm gần đây khi các nhà nghiên cứu về béo phì cố gắng tìm ra lý do tại sao một số thủ thuật chuyên khoa liên quan đến phẫu thuật sắp xếp lại dạ dày và ruột trên lại gây ra giảm cân và cải thiện lựa chọn chế độ ăn uống [1,2]. Các tế bào nội tiết ruột của ruột tạo ra một số lượng lớn các peptit điều chỉnh sự thèm ăn, nhiều peptit trong số đó đã bị thay đổi bài tiết liên quan đến phẫu thuật giảm cân [3] và giảm cân [4**]. Thật vậy, những hormone này không chỉ tác động đến các trung tâm não để điều chỉnh sự thèm ăn và kiểm soát trao đổi chất, mà còn đối với các con đường điều phối các hành vi liên quan đến mãn nguyện, tâm trạng, lo lắng, căng thẳng và trí nhớ. Điều thú vị là những hành vi như vậy cũng có thể bị ảnh hưởng bởi thành phần của hệ vi sinh vật đường ruột[2], giao tiếp với thần kinh trung ương có thể thông qua các con đường thần kinh, nội tiết và miễn dịch [5 **]. Hậu quả của việc thay đổi nội tiết đường ruột và biểu hiện vi sinh vật đối với hành vi là một lĩnh vực mới và đang phát triển. Ở đây, chúng tôi đặc biệt tập trung vào các hormone đường ruột điều chỉnh sự thèm ăn, bao gồm cả những hormone có liên quan đến kết quả giảm cân thành công của phẫu thuật giảm cân và ảnh hưởng của chúng đối với các hành vi có liên quan, quan trọng đối với việc kiểm soát sự thèm ăn, mãn nguyện và tâm trạng.
Trong sinh lý bình thường, sự bài tiết các hormone điều hòa sự thèm ăn của ruột được thay đổi theo nhu cầu trao đổi chất; trong khi nội tiết tố gây dị ứng ghrelin được tiết ra bởi các tế bào giống A trong dạ dày trước khi ăn và kết hợp với cảm giác đói [6], các peptit gây chán ăn giống như peptit glucagon 1 (GLP-1) và Peptide YY (PYY) được hình thành từ các tế bào L của ruột non, thể hiện ở cả tế bào nuôi cấy [7] và tế bào sống[3] sau bữa ăn [8,9]. GLP-1 thậm chí có thể được tiết ra trước bữa ăn, như là một phần của phản ứng tuần hoàn đối với dự đoán thức ăn [10,11].
Cholecystokinin (CCK), một peptide ruột gây biếng ăn khác được sản xuất bởi các tế bào I, dường như hoạt động như một hormone cảm giác no [12] và việc giải phóng nó được kích hoạt bởi sự hiện diện của thức ăn trong ruột, đặc biệt là liên quan đến các bữa ăn giàu chất béo và chất đạm [13]. Cả GLP-1 và CCK đều có thời gian bán hủy tương đối ngắn trong hệ tuần hoàn. Vì cả hai đều được tạo ra trong các nhóm tế bào rời rạc trong não [14,15], sẽ khó xác định liệu các hiệu ứng hành vi quan sát được sau khi phân phối ngoại sinh các peptit này có bắt chước tín hiệu não – ruột hoặc nó có nguồn gốc từ thần kinh trung ương hay không.
Một giả thuyết bao quát sẽ được thảo luận ở đây là nhiều tác động hành vi của các tế bào nội tiết ruột (enteroendocrine hormones)[4] có khả năng liên quan trực tiếp hoặc gián tiếp đến sự thèm ăn và kiểm soát trao đổi chất. Vì vậy, ví dụ, trong các bài kiểm tra hành vi đã được thiết lập về mãn nguyện, lo lắng, suy giảm và trí nhớ, động vật đói có khả năng hoạt động khác với phản ứng của động vật được cho ăn, ít nhất là một phần, nội tiết trục não – ruột bị thay đổi; Con vật đói sẽ có nhiều động lực hơn để tìm kiếm thức ăn và sẽ sẵn sàng vượt qua môi trường khắc nghiệt hơn để có được thức ăn.
Trước khi xem xét tác động của hormone đường ruột lên hành vi, điều quan trọng là phải thảo luận về sự phức tạp và hạn chế của những cuộc điều tra như vậy. Thứ nhất, như đã đề cập, một số peptit ‘ruột’ thực sự là peptit ruột/ não và do đó, sự thay đổi trong hành vi quan sát được có thể không được kiểm soát bởi nội tiết ruột mà thay vào đó là nguồn peptit não. Một ví dụ nổi bật ở đây là GLP-1, mà tác động trung tâm của nó có thể được thúc đẩy từ các nhóm tế bào trong thân não [14]. Thứ hai, độ nhạy cảm của não đối với hormone có thể thay đổi liên quan đến các trạng thái sinh học thực vật (bệnh) khác nhau, đặc biệt là những trạng thái liên quan đến thay đổi cân bằng năng lượng, cả ngắn hạn (ví dụ như nhịn ăn) và mãn tính (ví dụ: béo phì). Ít nhất đối với ghrelin, não có thể tăng nhạy cảm với hormone này khi nhịn ăn [16] và đề kháng với hormone này khi béo phì [17]. Thứ ba, các cấu trúc được đo lường trong các bài kiểm tra hành vi thường liên quan đến những thay đổi trong hoạt động vận động (ví dụ: tìm kiếm thức ăn, di chuyển vào một cánh đồng mở) và cũng liên quan đến việc xử lý bộ nhớ (ví dụ: một môi trường hoặc nhiệm vụ nhất định có liên quan đến kết quả có lợi hoặc bất lợi); nếu kết quả hành vi thay đổi do kết quả của việc sử dụng nội tiết tố, có thể khó loại trừ ảnh hưởng của hoạt động vận động và trí nhớ. Cuối cùng, kiểm tra hành vi phải kiểm soát cẩn thận về sự căng thẳng, điều này có thể thay đổi kết quả của hầu hết các kiểm tra hành vi và, trong một số trường hợp, cũng có thể cũng có thể thay đổi các nồng độ hormone của nội tiết ruột.
Hành vi cạnh tranh
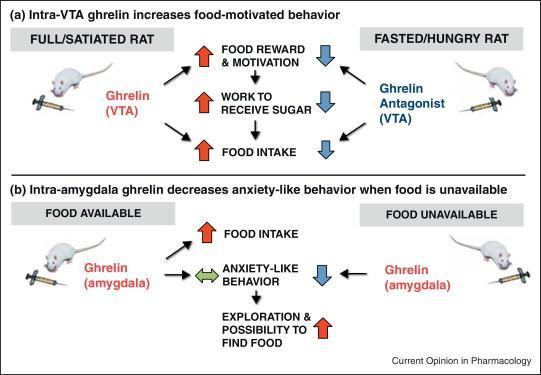
‘Hành vi cạnh tranh’ là một thuật ngữ bao trùm về cơ bản mô tả tất cả các hành vi xảy ra trước (và cuối cùng dẫn đến) việc tiêu thụ thức ăn. Những hành vi này thay đổi theo tình trạng trao đổi chất nhưng cũng có thể phản ánh giá trị khuyến khích (động lực) của thức ăn. Do đó, như một phép thử về phần thưởng thức ăn, động vật đói sẽ thể hiện sự ưa thích hơn đối với môi trường trước đây được ghép nối với phần thưởng thức ăn, ngay cả khi thức ăn không còn nữa – vì thế bài kiểm tra này gọi là “điều kiện ưa thích địa điểm” (condition place preference – CPP). Có những dấu hiệu cho thấy các tế bào nội tiết của ruột và/ hoặc hệ thống tín hiệu não của chúng ngăn chặn CPP đối với thức ăn, được minh chứng bởi các nghiên cứu sử dụng các tác nhân gây biếng ăn như chất chủ vận thụ thể GLP-1 tác dụng kéo dài, Exendin 4 [18*][5] và cả thụ thể ghrelin (GHS-R1A) chất đối kháng [19,20]. Các bằng chứng khác cho thấy các hormone đường ruột điều chỉnh phần thưởng thức ăn được gợi ý bởi các nghiên cứu khám phá giá trị động lực khuyến khích của phần thưởng thức ăn – được gọi là mô hình ‘phản ứng do chịu ảnh hưởng từ kết quả (operant responding), trong đó những con chuột được huấn luyện để nhấn cần lấy thức ăn sẽ ngày càng làm việc chăm chỉ để nhận được phần thưởng thức ăn. Trong thử nghiệm này, ghrelin đã được chứng minh là làm tăng động lực cho sucrose ở những con chuột được cho ăn đầy đủ, khi được phân phối từ ngoại vi, trung tâm [21] hoặc trực tiếp vào vùng não bụng (ventral tegmental area – VTA)[6] [22], một khu vực não quan trọng liên quan đến các hành vi tìm kiếm phần thưởng. [23] (Hình 1a). Ngược lại, một chất kháng hormone ghrelin đã được chứng minh là có thể ngăn chặn hành vi có động cơ để được thưởng đường sucrose, ngay cả ở những động vật nhịn ăn có lượng ghrelin nội sinh cao [21,22,24]. Trong một nghiên cứu khác, sử dụng chế độ ăn giàu chất béo như một chất củng cố, ức chế tín hiệu ghrelin ở chuột (cả về mặt dược lý và loại bỏ di truyền của GHS-R1A) đã ngăn chặn hành vi thưởng thức ăn trong CPP và mô hình phản ứng hoạt động [20]. Tác động của ghrelin đối với hành vi phần thưởng thức ăn liên quan đến hệ thống dopamine ở não giữa [25–27] có vai trò thiết lập trong động lực khuyến khích (tức là mong muốn). Đáng chú ý, dopamine não giữa có thể không cần thiết cho việc tiêu thụ thức ăn do ghrelin gây ra mà không đòi hỏi nỗ lực đáng kể, cho thấy rằng hệ thống mạch thần kinh kiểm soát việc tìm kiếm thức ăn dựa trên nỗ lực có thể khác với việc kiểm soát đơn giản lượng ăn vào [28]. Ghrelin dường như không nhắm mục tiêu trực tiếp đến sự ngon miệng của thực phẩm [29] – yếu tố liên quan đến việc ăn uống theo chủ nghĩa khoái lạc (tức là thích thú). Do đó, ghrelin dường như đóng một vai trò trong việc ăn uống quá mức, vượt quá nhu cầu trao đổi chất, đặc biệt là thúc đẩy các hành vi dẫn đến việc tiêu thụ các thức ăn ngon miệng/ bổ ích có nhiều calo [25]. Hệ thống tín hiệu ghrelin trung tâm cũng được liên kết với một số lượng lớn các hành vi khoái khẩu khác, bao gồm, ví dụ, hoạt động dự đoán thức ăn ở loài gặm nhấm [30,31] và hành vi tích trữ và kiếm thức ăn ở chuột đồng Siberia [32].
Không phải tất cả các hormone nội tiết ‘sau ăn’ đều được chứng minh là có vai trò rõ ràng trong việc ngăn chặn hành vi tiêu thụ thức ăn ở loài gặm nhấm. Điều này có lẽ không có gì đáng ngạc nhiên vì xét từ góc độ tiến hóa, việc hạn chế ăn quá nhiều thức ăn, đặc biệt là những thức ăn ngon miệng có giá trị dinh dưỡng đa dạng, có thể không có lợi khi có sẵn thức ăn để dự trữ năng lượng cho nạn đói trong tương lai. Các trung tâm não liên quan đến đánh giá cân bằng nội môi và khoái cảm [33] đối với thực phẩm đã được chứng minh là đã thay đổi hoạt động sau khi phân phối PYY cho đối tượng người đang nhịn ăn [34]. Mặc dù cả PYY và NPY đều liên kết với thụ thể NPY-Y1, theo hiểu biết sâu nhất của chúng tôi, chỉ NPY được chứng minh là có tác động đến hành vi thúc đẩy thức ăn ở loài gặm nhấm [35]. Tương tự như vậy, tín hiệu CCK trung tâm vẫn chưa được chứng minh là có thể thay đổi hành vi phần thưởng thức ăn, mặc dù có nhiều tài liệu liên quan đến việc phát tín hiệu CCK với việc phần thưởng thuốc hóa học [36] và sự lo lắng [37]. Hệ thống tín hiệu GLP-1 trung tâm nổi bật như là hormone ‘ruột’ gây biếng ăn duy nhất có vai trò rõ ràng trong việc ngăn chặn hành vi phần thưởng thức ăn. Do đó, việc sử dụng Exendin 4 ở ngoại vi ngăn chặn CPP đối với viên sô cô la và cũng như phản ứng hoạt động đối với viên đường sucrose, liên quan đến tín hiệu thông qua các thụ thể GLP-1 trung tâm [18*]. Không giống như ghrelin, GLP-1 cũng có liên quan đến việc giảm độ ngon của thực phẩm [38]. Tế bào thần kinh sản xuất GLP-1 của não sau có thể cung cấp trực tiếp GLP-1 vào các vùng thưởng trung mô, một lần nữa khiến cho việc phân biệt ruột hay não là nguồn nội sinh liên quan của chất chủ vận trở nên khó khăn [39–41].
Hành vi khen thưởng cho hành vi lạm dụng thuốc hóa học
Các chất lạm dụng hóa học về cơ bản chiếm đoạt hệ thống khen thưởng tự nhiên của não bộ. Do các vùng não liên quan đến quá trình xử lý phần thưởng biểu hiện các thụ thể peptit trong ruột như ghrelin [42], PYY [43], CCK [44] và GLP-1 [45], có lẽ không có gì đáng ngạc nhiên khi một số hormone ruột thay đổi hành vi khen thưởng đối với các chất hóa học bị lạm dụng, và không chỉ phần thưởng tự nhiên như thực phẩm. Thật vậy, các hormone đường ruột điều chỉnh phần thưởng thức ăn làm thay đổi sự hình thành (và hành vi khen thưởng) đối với các chất tăng cường phần thưởng nhân tạo như rượu [46,47] và cocaine [48,49]. Trong mô hình tiếp cận có giới hạn lựa chọn tự do (rượu/ nước), lượng rượu uống vào đã được chứng minh là tăng lên bởi lượng ghrelin qua đường miệng, trong não thất (ICV) hoặc trong VTA và ức chế bởi GLP-1 hoặc Chất chủ vận GLP-1 phân phối ngoại vi [46,50] hoặc trong VTA [46]. Thật vậy, trong những nghiên cứu này, CPP đối với rượu cũng như các thông số khen thưởng khác đã được chứng minh là bị ức chế khi sử dụng qua đường tiêm đối với chất đối kháng ghrelin và chất chủ vận GLP-1. Cả ghrelin và GLP-1 đều đã được điều tra về khả năng liên quan đến việc phần thưởng thuốc hóa học và các hành vi liên quan ở loài gặm nhấm. Phù hợp với các kết quả được mô tả ở trên đối với phần thưởng thức ăn, ghrelin dường như tăng lên trong khi GLP-1 có thể làm giảm các hành vi do cocaine và amphetamine gây ra [48,49,51].
Phản ứng cảm xúc và tâm trạng
Khi mô tả các nghiên cứu hành vi khám phá tác động của các hormone nội tiết đường ruột lên phản ứng cảm xúc, điều quan trọng là phải nhận ra rằng các xét nghiệm cổ điển được sử dụng đã được phát triển để đánh giá các loại thuốc chống lo âu và chống trầm cảm. Ví dụ, nếu một con chuột dành nhiều thời gian hơn trong cánh tay mở trong mê cung trên cao, thì con chuột đó được coi là ít lo lắng hơn. Tuy nhiên, nếu đói, hành vi này có thể phản ánh hành vi khám phá ngày càng tăng để tìm thức ăn. Do đó, thuật ngữ ‘giống như lo lắng’ đã được đặt ra để mô tả kết quả hành vi của các bài kiểm tra như vậy. Trong các nghiên cứu khác nhau, ghrelin đã được gợi ý để làm tăng hành vi giống như lo lắng ở chuột [52–55], bao gồm cả trong một nghiên cứu mãn tính trong đó ghrelin được đưa đến não [56] và nghịch lý là làm giảm tác dụng trầm cảm và lo âu của căng thẳng cấp tính ở chuột [57]. Trong một nghiên cứu gần đây, chúng tôi đã tìm cách làm rõ sự khác biệt này bằng cách hướng dẫn truyền ghrelin đến hạch hạnh nhân, một khu vực não quan trọng liên quan đến phản ứng cảm xúc và đặc biệt là đến một phần của hạch hạnh nhân nơi có nhiều GHS-R1A nhất. Chúng tôi nhận thấy rằng việc sử dụng ghrelin trong hạch hạnh nhân làm giảm các hành vi giống như lo lắng (trong các thử nghiệm trên cao cộng với mê cung và ngoài trời) nhưng chỉ ở những con chuột không được phép cho ăn trong khoảng thời gian 1 giờ đầu sau khi tiêm ghrelin [58*] (Hình 1b) . Cùng với ý kiến cho rằng hành vi giống như lo lắng và sự khám phá được điều chỉnh theo cách ngược lại bởi ghrelin, gần đây chúng tôi đã chỉ ra rằng những con chuột không được tiếp cận với thức ăn sau khi tiêm ghrelin sẽ tăng hành vi tìm kiếm sự mới lạ của chúng [59]. Do đó, khi không có thức ăn, tín hiệu đói do ghrelin cung cấp có thể ngăn chặn các hành vi giống như lo lắng để giúp con vật tìm thức ăn. Trong khi vai trò của ghrelin trong hành vi giống như lo lắng vẫn còn gây tranh cãi, rất nhiều bằng chứng liên kết CCK với hành vi lo lắng (xem [60,61] để xem xét). Cả nghiên cứu trên người và loài gặm nhấm đều chỉ ra rõ ràng rằng CCK tăng cao có liên quan đến việc gia tăng hành vi giống như lo lắng. Hiệu ứng này được chứng minh trong nhiều mô hình lo lắng, bao gồm cả những mô hình dựa trên sự thăm dò cũng như những mô hình giật mình có tiềm năng. Vị trí ảnh hưởng dường như là trung tâm, với hạch hạnh nhân ba bên và ở một mức độ nào đó, vùng đồi thị và vỏ não là mục tiêu trực tiếp cho các tác động gây lo lắng của CCK [62-64].
Sự đóng góp của GLP-1 và các thụ thể của nó đối với các hành vi lo lắng ít rõ ràng hơn và các kết quả dường như trái ngược nhau đã thu được trong các nghiên cứu ở người và loài gặm nhấm. Ở loài gặm nhấm, tiêm GLP-1 trung tâm làm giảm thời gian khám phá cánh tay mở của mê cung cộng cao, một hiệu ứng bắt chước bằng cách tiêm GLP-1 trực tiếp trong hạch hạnh nhân [65]. Tuy nhiên, dữ liệu sẵn có của con người lại cho thấy điều hoàn toàn ngược lại, GLP-1 có vai trò trong việc giảm lo lắng. Truyền GLP-1 trong thời gian ngắn không gây lo lắng ở những đối tượng khỏe mạnh [66]. Hơn nữa, ở những bệnh nhân tiểu đường loại 2, sử dụng liệu pháp dựa trên GLP-1 trong 6 tháng làm giảm điểm số lo lắng và trầm cảm [67].
Ghrelin, GLP-1 và CCK cũng đã được điều tra về vai trò của chúng trong các cuộc tấn công hoảng sợ. Trong khi CCK dẫn đến sự kích thích đáng tin cậy của các cơn hoảng loạn, ngay cả ở người khỏe mạnh, GLP-1 không tạo ra bất kỳ thay đổi nào ở cả đối tượng khỏe mạnh và những người được chẩn đoán mắc chứng rối loạn hoảng sợ [66]. Đối với ghrelin, một nghiên cứu cho thấy sự đa hình trong gen preproghrelin có liên quan đến chứng rối loạn hoảng sợ [68] nhưng một nghiên cứu khác lại báo cáo không có mối liên quan nào [69].
Kết luận
Tóm lại, các peptit điều chỉnh sự thèm ăn trong nội tiết ruột có tác động đến một số hành vi, nhiều hành vi trong số đó có khả năng liên quan trực tiếp hoặc gián tiếp đến việc kiểm soát việc cho ăn. Từ góc độ điều trị, các hormone và thuốc đường ruột can thiệp vào cơ chế truyền tín hiệu não của chúng, có thể tiềm ẩn nguy cơ phát triển các bệnh khác ngoài béo phì và rối loạn ăn uống, bao gồm hành vi gây nghiện và rối loạn lo âu.
Người dịch: Sophia Ngo
Nguồn: Skibicka KP, Dickson SL. Enteroendocrine hormones – central effects on behavior. Curr Opin Pharmacol. 2013 Dec;13(6):977-82. doi: 10.1016/j.coph.2013.09.004. Epub 2013 Oct 1. PMID: 24091195.
[1] Một số hormone nội tiết đường ruột quan trọng, bao gồm ghrelin, PYY và CCK được thảo luận ở đây, có thể bị thay đổi vĩnh viễn sau khi giảm cân, khiến bệnh nhân phải lấy lại cân nặng trước đó. Do đó, việc hiểu rõ loại hormone nào trong số những hormone này làm thay đổi hành vi làm tăng cảm giác đói, ham muốn thức ăn và động cơ kiếm thức ăn có thể giúp tạo ra các liệu pháp hiệu quả trong việc ngăn ngừa tái phát trạng thái béo phì.
[2] Hệ vi sinh vật đường ruột có thể là nhân tố chính mới điều chỉnh tín hiệu nội tiết ruột và do đó bao gồm cả điều chỉnh hành vi
[3] Những thí nghiệm được gọi là in vivo là trong đó những tác động của các tổ chức sinh học được thử nghiệm trên toàn bộ, sinh vật hoặc các tế bào còn sống, thường là động vật, kể cả con người, và thực vật, trái ngược với một các mẫu mô rời hoặc các sinh vật đã chết. (ND)
[4] Tế bào nội tiết ruột là những tế bào chuyên biệt của ống tiêu hóa và tuyến tụy có chức năng nội tiết. Chúng tạo ra các hormone hoặc peptide ở đường tiêu hóa để đáp ứng với các kích thích khác nhau và giải phóng chúng vào máu để gây hiệu ứng toàn thân, khuếch tán chúng như những sứ giả tại chỗ, hoặc truyền chúng đến hệ thần kinh ruột để kích hoạt các phản ứng thần kinh. Tế bào nội tiết của ruột có lượng tế bào nội tiết nhiều nhất của cơ thể. Chúng tạo thành hệ thống nội tiết ruột như một tập hợp con của hệ thống nội tiết cũng như hệ thống thần kinh ruột là một tập hợp con của hệ thần kinh. (ND)
[5] Bằng chứng đầu tiên cho thấy chất chủ vận GLP-1 được sử dụng trên lâm sàng, Exendin 4, làm giảm hành vi phần thưởng thức ăn và làm như vậy bằng cách kích thích các thụ thể GLP-1 trung bình. Phát hiện này nhấn mạnh sự cần thiết phải hiểu đầy đủ về tác động của các hormone đường ruột lên não và hành vi, đồng thời chỉ ra rằng tác động này của GLP-1 còn vượt xa so với những gì có thể được mong đợi ban đầu từ một hormone điều hòa đường huyết.
[6] VTA là một nhóm tế bào thần kinh nằm gần đường giữa trên sàn của não giữa. VTA là nguồn gốc của cơ thân tế bào dopaminergic của hệ thống dopamine mesocorticolimbic và các con đường dopamine khác; nó có liên quan rộng rãi đến thuốc và mạch tưởng thưởng tự nhiên của não. VTA đóng một vai trò quan trọng trong một số quá trình, bao gồm nhận thức về sự mãn nguyện (khả năng động viên, học tập kết hợp và cảm xúc được đánh giá tích cực) và cực khoái. (ND)
Tài liệu tham khảo và đề xuất đọc
Các bài báo được quan tâm đặc biệt, được xuất bản trong thời gian xem xét, đã được đánh dấu là:
*quan tâm đặc biệt
** đáng chú ý
- Laurenius A, Larsson I, Bueter M, Melanson KJ, Bosaeus I, Forslund HB, Lonroth H, Fandriks L, Olbers T: Changes in eating behaviour and meal pattern following Roux-en-Y gastric bypass. Int J Obes (Lond) 2012, 36:348-355.
- le Roux CW, Welbourn R, Werling M, Osborne A, Kokkinos A, Laurenius A, Lonroth H, Fandriks L, Ghatei MA, Bloom SR et al.: Gut hormones as mediators of appetite and weight loss after Roux-en-Y gastric bypass. Ann Surg 2007, 246:780-785.
- Vincent RP, le Roux CW: Changes in gut hormones after bariatric surgery. Clin Endocrinol (Oxf) 2008, 69:173-179.
- Sumithran P, Prendergast LA, Delbridge E, Purcell K, Shulkes A, Kriketos A, Proietto J: Long-term persistence of hormonal adaptations to weight loss. N Engl J Med 2011, 365:1597-1604. (**)
Một số hormone nội tiết đường ruột quan trọng, bao gồm ghrelin, PYY và CCK được thảo luận ở đây, có thể bị thay đổi vĩnh viễn sau khi giảm cân, khiến bệnh nhân phải lấy lại cân nặng trước đó. Do đó, việc hiểu rõ loại hormone nào trong số những hormone này làm thay đổi hành vi làm tăng cảm giác đói, ham muốn thức ăn và động cơ kiếm thức ăn có thể giúp tạo ra các liệu pháp hiệu quả trong việc ngăn ngừa tái phát trạng thái béo phì.
- Cryan JF, Dinan TG: Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci 2012, 13:701-712. (**)
Hệ vi sinh vật đường ruột có thể là nhân tố chính mới điều chỉnh tín hiệu nội tiết ruột và do đó bao gồm cả điều chỉnh hành vi
- Cummings DE, Frayo RS, Marmonier C, Aubert R, Chapelot D: Plasma ghrelin levels and hunger scores in humans initiating meals voluntarily without time- and food-related cues. Am J Physiol Endocrinol Metab 2004, 287:E297-E304.
- Habib AM, Richards P, Rogers GJ, Reimann F, Gribble FM: Co-localisation and secretion of glucagon-like peptide 1 and peptide YY from primary cultured human L Diabetologia 2013, 56:1413-1416.
- Ghatei MA, Uttenthal LO, Christofides ND, Bryant MG, Bloom SR: Molecular forms of human enteroglucagon in tissue and plasma: plasma responses to nutrient stimuli in health and in disorders of the upper gastrointestinal J Clin Endocrinol Metab 1983, 57:488-495.
- Diakogiannaki E, Gribble FM, Reimann F: Nutrient detection by incretin hormone secreting cells. Physiol Behav 2012, 106:387-393.
- Williams DL: Expecting to eat: glucagon-like peptide-1 and the anticipation of meals. Endocrinology 2010, 151:445-447.
- Vahl TP, Drazen DL, Seeley RJ, D’Alessio DA, Woods SC: Meal-anticipatory glucagon-like peptide-1 secretion in rats. Endocrinology 2010, 151:569-575.
- Gibbs J, Young RC, Smith GP: Cholecystokinin decreases food intake in rats. J Comp Physiol Psychol 1973, 84:488-495.
- Liddle RA, Goldfine ID, Rosen MS, Taplitz RA, Williams JA: Cholecystokinin bioactivity in human plasma, molecular forms, responses to feeding, and relationship to gallbladder J Clin Invest 1985, 75:1144-1152.
- Larsen PJ, Tang-Christensen M, Holst JJ, Orskov C: Distribution of glucagon-like peptide-1 and other preproglucagon-derived peptides in the rat hypothalamus and brainstem. Neuroscience 1997, 77:257-270.
- Beinfeld MC, Meyer DK, Eskay RL, Jensen RT, Brownstein MJ: The distribution of cholecystokinin immunoreactivity in the central nervous system of the rat as determined by Brain Res 1981, 212:51-57.
- Hewson AK, Dickson SL: Systemic administration of ghrelin induces Fos and Egr-1 proteins in the hypothalamic arcuate nucleus of fasted and fed rats. J Neuroendocrinol 2000, 12:1047-1049.
- Briggs DI, Enriori PJ, Lemus MB, Cowley MA, Andrews ZB: Diet-induced obesity causes ghrelin resistance in arcuate NPY/ AgRP neurons. Endocrinology 2010, 151:4745-4755.
- Dickson SL, Shirazi RH, Hansson C, Bergquist F, Nissbrandt H, Skibicka KP: The glucagon-like peptide 1 (GLP-1) analogue, exendin-4, decreases the rewarding value of food: a new role for mesolimbic GLP-1 receptors. J Neurosci 2012, 32:4812- (*)
Bằng chứng đầu tiên cho thấy chất chủ vận GLP-1 được sử dụng trên lâm sàng, Exendin 4, làm giảm hành vi phần thưởng thức ăn và làm như vậy bằng cách kích thích các thụ thể GLP-1 trung bình. Phát hiện này nhấn mạnh sự cần thiết phải hiểu đầy đủ về tác động của các hormone đường ruột lên não và hành vi, đồng thời chỉ ra rằng tác động này của GLP-1 còn vượt xa so với những gì có thể được mong đợi ban đầu từ một hormone điều hòa đường huyết.
- Egecioglu E, Jerlhag E, Salome N, Skibicka KP, Haage D, Bohlooly YM, Andersson D, Bjursell M, Perrissoud D, Engel JA et : Ghrelin increases intake of rewarding food in rodents. Addict Biol 2010, 15:304-311.
- Perello M, Sakata I, Birnbaum S, Chuang JC, Osborne-Lawrence S, Rovinsky SA, Woloszyn J, Yanagisawa M, Lutter M, Zigman JM: Ghrelin increases the rewarding value of high-fat diet in an orexin-dependent manner. Biol Psychiatry 2010, 67:880-886.
- Skibicka KP, Hansson C, Egecioglu E, Dickson SL: Role of ghrelin in food reward: impact of ghrelin on sucrose self-administration and mesolimbic dopamine and acetylcholine receptor gene expression. Addict Biol 2012, 17:95-107.
- Skibicka KP, Hansson C, Alvarez-Crespo M, Friberg PA, Dickson SL: Ghrelin directly targets the ventral tegmental area to increase food Neuroscience 2011, 180:129-137.
- Robinson TE, Berridge KC: The neural basis of drug craving: an incentive-sensitization theory of addiction. Brain Res Brain Res Rev 1993, 18:247-291.
- Skibicka KP, Dickson SL: Ghrelin and food reward: the story of potential underlying Peptides 2011, 32:2265-2273.
- Dickson SL, Egecioglu E, Landgren S, Skibicka KP, Engel JA, Jerlhag E: The role of the central ghrelin system in reward from food and chemical Mol Cell Endocrinol 2011, 340:80-87.
- Abizaid A, Liu ZW, Andrews ZB, Shanabrough M, Borok E, Elsworth JD, Roth RH, Sleeman MW, Picciotto MR, Tschop MH et al.: Ghrelin modulates the activity and synaptic input organization of midbrain dopamine neurons while promoting J Clin Invest 2006, 116:3229-3239.
- Jerlhag E, Egecioglu E, Dickson SL, Andersson M, Svensson L, Engel JA: Ghrelin stimulates locomotor activity and accumbal dopamine-overflow via central cholinergic systems in mice: implications for its involvement in brain reward. Addict Biol 2006, 11:45-54.
- Skibicka KP, Shirazi RH, Rabasa-Papio C, Alvarez-Crespo M, Neuber C, Vogel H, Dickson SL: Divergent circuitry underlying food reward and intake effects of ghrelin: dopaminergic VTA-accumbens projection mediates ghrelin’s effect on food reward but not food intake. Neuropharmacology 2013, 73C:274-283.
- Overduin J, Figlewicz DP, Bennett-Jay J, Kittleson S, Cummings DE: Ghrelin increases the motivation to eat, but does not alter food palatability. Am J Physiol Regul Integr Comp Physiol 2012, 303:R259-R269.
- Merkestein M, Brans MA, Luijendijk MC, de Jong JW, Egecioglu E, Dickson SL, Adan RA: Ghrelin mediates anticipation to a palatable meal in rats. Obesity 2012, 20:963-971.
- Verhagen LA, Egecioglu E, Luijendijk MC, Hillebrand JJ, Adan RA, Dickson SL: Acute and chronic suppression of the central ghrelin signaling system reveals a role in food anticipatory Eur Neuropsychopharmacol 2011, 21:384-392.
- Keen-Rinehart E, Bartness TJ: Peripheral ghrelin injections stimulate food intake, foraging, and food hoarding in Siberian Am J Physiol Regulat Integr Comp Physiol 2005, 288:R716-R722.
- Hokfelt T, Rehfeld JF, Skirboll L, Ivemark B, Goldstein M, Markey K: Evidence for coexistence of dopamine and CCK in meso-limbic neurones. Nature 1980, 285:476-478.
- Batterham RL, ffytche DH, Rosenthal JM, Zelaya FO, Barker GJ, Withers DJ, Williams SC: PYY modulation of cortical and hypothalamic brain areas predicts feeding behaviour in Nature 2007, 450:106-109.
- Pandit R, la Fleur SE, Adan RA: The role of melanocortins and neuropeptide Y in food Eur J Pharmacol 2013. In press.
- Rotzinger S, Vaccarino FJ: Cholecystokinin receptor subtypes: role in the modulation of anxiety-related and reward-related behaviours in animal models. J Psychiatry Neurosci 2003, 28:171-181.
- Dauge V, Lena I: CCK in anxiety and cognitive Neurosci Biobehav Rev 1998, 22:815-825.
- Dossat AM, Diaz R, Gallo L, Panagos A, Kay K, Williams DL: Nucleus accumbens GLP-1 receptors influence meal size and Am J Physiol Endocrinol Metab 2013, 304:E1314-E1320.
- Dossat AM, Lilly N, Kay K, Williams DL: Glucagon-like peptide 1 receptors in nucleus accumbens affect food J Neurosci 2011, 31:14453-14457.
- Alhadeff AL, Rupprecht LE, Hayes MR: GLP-1 neurons in the nucleus of the solitary tract project directly to the ventral tegmental area and nucleus accumbens to control for food Endocrinology 2012, 153:647-658.
- Rinaman L: Ascending projections from the caudal visceral nucleus of the solitary tract to brain regions involved in food intake and energy expenditure. Brain Res 2010, 1350:18-34.
- Guan XM, Yu H, Palyha OC, McKee KK, Feighner SD, Sirinathsinghji DJ, Smith RG, Van der Ploeg LH, Howard AD: Distribution of mRNA encoding the growth hormone secretagogue receptor in brain and peripheral Brain Res Mol Brain Res 1997, 48:23-29.
- Caberlotto L, Fuxe K, Sedvall G, Hurd YL: Localization of neuropeptide Y Y1 mRNA in the human brain: abundant expression in cerebral cortex and Eur J Neurosci 1997, 9:1212-1225.
- Carlberg M, Gundlach AL, Mercer LD, Beart PM: Autoradiographic localization of cholecystokinin A and B receptors in rat brain using [125I]d-Tyr25 (Nle28,31)-CCK 25- Eur J Neurosci 1992, 4:563-573.
- Merchenthaler I, Lane M, Shughrue P: Distribution of pre-pro-glucagon and glucagon-like peptide-1 receptor messenger RNAs in the rat central nervous J Comp Neurol 1999, 403:261-280.
- Shirazi RH, Dickson SL, Skibicka KP: Gut peptide GLP-1 and its analogue, Exendin-4, decrease alcohol intake and reward. PLoS ONE 2013, 8:e61965.
- Jerlhag E, Egecioglu E, Landgren S, Salome N, Heilig M, Moechars D, Datta R, Perrissoud D, Dickson SL, Engel JA: Requirement of central ghrelin signaling for alcohol Proc Natl Acad Sci U S A 2009, 106:11318-11323.
- Wellman PJ, Davis KW, Nation JR: Augmentation of cocaine hyperactivity in rats by systemic ghrelin. Regul Pept 2005, 125:151-154.
- Graham DL, Erreger K, Galli A, Stanwood GD: GLP-1 analog attenuates cocaine Mol Psychiatry 2013, 18:961-962.
- Davis JF, Schurdak JD, Magrisso IJ, Mul JD, Grayson BE, Pfluger PT, Tschop MH, Seeley RJ, Benoit SC: Gastric bypass surgery attenuates ethanol consumption in ethanol-preferring Biol Psychiatry 2012, 72:354-360.
- Erreger K, Davis AR, Poe AM, Greig NH, Stanwood GD, Galli A: Exendin-4 decreases amphetamine-induced locomotor Physiol Behav 2012, 106:574-578.
- Asakawa A, Inui A, Kaga T, Yuzuriha H, Nagata T, Fujimiya M, Katsuura G, Makino S, Fujino MA, Kasuga M: A role of ghrelin in neuroendocrine and behavioral responses to stress in Neuroendocrinology 2001, 74:143-147.
- Carlini VP, Monzon ME, Varas MM, Cragnolini AB, Schioth HB, Scimonelli TN, de Barioglio SR: Ghrelin increases anxiety-like behavior and memory retention in Biochem Biophys Res Commun 2002, 299:739-743.
- Carlini VP, Varas MM, Cragnolini AB, Schioth HB, Scimonelli TN, de Barioglio SR: Differential role of the hippocampus, amygdala, and dorsal raphe nucleus in regulating feeding, memory, and anxiety-like behavioral responses to ghrelin. Biochem Biophys Res Commun 2004, 313:635-641.
- Currie PJ, Khelemsky R, Rigsbee EM, Dono LM, Coiro CD, Chapman CD, Hinchcliff K: Ghrelin is an orexigenic peptide and elicits anxiety-like behaviors following administration into discrete regions of the Behav Brain Res 2012, 226:96-105.
- Hansson C, Haage D, Taube M, Egecioglu E, Salome N, Dickson SL: Central administration of ghrelin alters emotional responses in rats: behavioural, electrophysiological and molecular evidence. Neuroscience 2011, 180:201-211.
- Lutter M, Sakata I, Osborne-Lawrence S, Rovinsky SA, Anderson JG, Jung S, Birnbaum S, Yanagisawa M, Elmquist JK, Nestler EJ et al.: The orexigenic hormone ghrelin defends against depressive symptoms of chronic Nat Neurosci 2008, 11:752-753.
- Alvarez-Crespo M, Skibicka KP, Farkas I, Molnar CS, Egecioglu E, Hrabovszky E, Liposits Z, Dickson SL: The amygdala as a neurobiological target for ghrelin in rats: neuroanatomical, electrophysiological and behavioral PLoS ONE 2012, 7:e46321. (*)
Hormone đường ruột, ghrelin, có thể làm thay đổi hành vi giống như lo lắng nhưng tác động này không ảnh hưởng đến tính khả dụng của thức ăn. Vì vậy, khi xác định vai trò của hormone đường ruột đối với hành vi, điều quan trọng là phải xem xét tình trạng ăn uống của động vật.
- Hansson C, Shirazi RH, Naslund J, Vogel H, Neuber C, Holm G, Anckarsater H, Dickson SL, Eriksson E, Skibicka KP: Ghrelin influences novelty seeking behavior in rodents and men. PLoS ONE 2012, 7:e50409.
- Harro J: CCK and NPY as anti-anxiety treatment targets: promises, pitfalls, and Amino Acids 2006, 31:215-230.
- Bowers ME, Choi DC, Ressler KJ: Neuropeptide regulation of fear and anxiety: implications of cholecystokinin, endogenous opioids, and neuropeptide Y. Physiol Behav 2012, 107:699-710.
- Del Boca C, Lutz PE, Le Merrer J, Koebel P, Kieffer BL: Cholecystokinin knock-down in the basolateral amygdala has anxiolytic and antidepressant-like effects in mice. Neuroscience 2012, 218:185-195.
- Truitt WA, Johnson PL, Dietrich AD, Fitz SD, Shekhar A: Anxiety-like behavior is modulated by a discrete subpopulation of interneurons in the basolateral Neuroscience 2009, 160:284-294.
- Rezayat M, Roohbakhsh A, Zarrindast MR, Massoudi R, Djahanguiri B: Cholecystokinin and GABA interaction in the dorsal hippocampus of rats in the elevated plus-maze test of Physiol Behav 2005, 84:775-782.
- Kinzig KP, D’Alessio DA, Herman JP, Sakai RR, Vahl TP, Figueiredo HF, Murphy EK, Seeley RJ: CNS glucagon-like peptide-1 receptors mediate endocrine and anxiety responses to interoceptive and psychogenic stressors. J Neurosci 2003, 23:6163-6170.
- Strawn JR, D’Alessio DA, Keck PE Jr, Seeley RJ: Failure of glucagon-like peptide-1 to induce panic attacks or anxiety in patients with panic disorder. J Psychiatr Res 2008, 42:787-789.
- Grant P, Lipscomb D, Quin J: Psychological and quality of life changes in patients using GLP-1 analogues. J Diabetes Complications 2011, 25:244-246.
- Hansson C, Annerbrink K, Nilsson S, Bah J, Olsson M, Allgulander C, Andersch S, Sjodin I, Eriksson E, Dickson SL: A possible association between panic disorder and a polymorphism in the Psychiatry Res 2013, 206:22-25.
- Nakashima K, Akiyoshi J, Hatano K, Hanada H, Tanaka Y, Tsuru J, Matsushita H, Kodama K, Isogawa K: Ghrelin gene polymorphism is associated with depression, but not panic Psychiatr Genet 2008, 18:257.
- Skibicka KP, Shirazi RH, Hansson C, Dickson SL: Ghrelin interacts with neuropeptide Y Y1 and opioid receptors to increase food Endocrinology 2012, 153:1194-1205.